题目内容
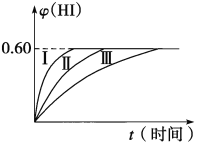
【题目】将2 mol I2(g)和1 mol H2置于某2 L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)![]() 2HI(g) ΔH<0,并达平衡,HI的体积分数φ(HI)随时间变化如图曲线(Ⅱ)所示。
2HI(g) ΔH<0,并达平衡,HI的体积分数φ(HI)随时间变化如图曲线(Ⅱ)所示。
(1)达平衡时,I2(g)的物质的量浓度为_______。
(2)若保持温度不变,在另一相同的2 L的密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是______。
【答案】0.55 mol·L-1 4b+c=2a
【解析】
(1)根据HI的体积分数计算平衡时HI的物质的量,再根据HI和I2之间的额关系式计算剩余的I2,进一步计算浓度;
(2)新平衡与原平衡等效,据此分析判断。
(1)该反应是等体积的反应,因此反应后混合气体的物质的量为3mol,同一容器中各气体的体积分数等于物质的量分数,所以平衡时HI的物质的量为3mol×0.6=1.8mol,参加反应的I2的物质的量为1.8mol×![]() =0.9mol,剩余的I2的物质的量为2mol-0.9mol=1.1mol,平衡时c(I2)=
=0.9mol,剩余的I2的物质的量为2mol-0.9mol=1.1mol,平衡时c(I2)=![]() =0.55mol/L;
=0.55mol/L;
(2)若温度不变,在另一个相同的2 L的密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0)发生反应达到平衡时,HI的体积分数仍为0.6,说明新平衡与原平衡等效,那么:
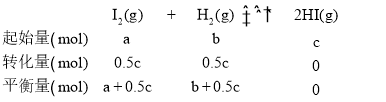
有![]() =
=![]() ,因此有4b+c=2a。
,因此有4b+c=2a。

【题目】CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g)![]() N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的浓度如下:
浓度/(mol/L)/时间/min | 0 | 10 | 20 | 30 | 40 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
CO2 | 0 | 0.42 | 080 | 0.80 | 1.2 |
①根据图表数据分析T1℃时,该反应在0~10min内的平均反应速率v(N2)=___mol·L-1·min-1;计算该反应的平衡常数K=__。
②若30min后只改变某一条件,据上表中的数据判断改变的条件可能是__(填字母编号)。
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率___(填“升高”或“降低”),△H__0(填“>”或“<”)。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1
2CH3OH(g) ![]() CH3OCH3(g)+H
CH3OCH3(g)+H
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式___。
(3)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-):c(HCO3-)=__。[常温下K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11]。
② 欲用5L Na2CO3溶液将23.3 g BaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为_________。[已知:常温下Ksp(BaSO4)=1×10-7、Ksp(BaCO3)=2.5×10-6]。(忽略溶液体积积的变化)
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测。某工厂对制铬工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸液中金属离子主要是Cr3+,其次是Fe3+, Fe2+, Al3+, Ca2+, Mg2+)

常温下部分阳离子的氢氧化物形成沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | — |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0(>9.0溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是_____________________________(至少一条)
(2)调pH=4.0是为了除去______________________(填Fe3+, Al3+, Ca2+, Mg2+)
(3)钠离子交换树脂的原理为Mn++ n NaR → MRn+nNa+,被交换的杂质离子是___________________________(填Fe3+, Al3+, Ca2+, Mg2+)
(4)试配平下列氧化还原反应方程式:
____Na2Cr2O7+__SO2+____H2O =____Cr(OH)(H2O)5SO4+___Na2SO4