题目内容
1克氢气燃烧生成液态水放出142.9 kJ热量,表示该反应的热化学方程式正确的是( )
| A.2H2(g)+O2(g)=2H2O(l);△H="-285.8" kJ/mol |
| B.H2(g)+1/2O2(g)=H2O(g);△H=-142.9kJ/mol |
| C.H2O(l)=H2(g)+1/2O2(g); △H="+285.8" kJ/mol |
| D.2H2+O2=2H2O;△H="-571.6" kJ/mol |
C
解析试题分析:A项:放热应为571.6kJ/mol,错误;B项:方程式中生成的是气态水,而题中给出的是液态水,错误;C项有盖斯定律确定为正确;D项:方程式中未标出物质的聚集状态,错误。
考点:热化学方程式的书写。

对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH=?的化学反应,下列叙述不正确的是
| A.反应过程中能量关系如上图表示,则该反应为放热反应 |
| B.若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
| C.化学反应的焓变与反应方程式的计量系数有关 |
| D.若将该反应设计成原电池,锌为负极 |
对于:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l);△H =-5800kJ/mol的叙述错误的是
| A.该反应的反应热为△H=-5800kJ/mol,是放热反应 |
| B.该反应的△H与各物质的状态有关,与化学计量数也有关 |
| C.该式的含义为:25℃、101kPa下,2mol C4H10气体完全燃烧生成CO2和液态水时放出热量5800kJ |
| D.该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5800kJ/mol |
下列说法正确的组合是( )
(1)放热反应不需要加热就能反应,吸热反应不加热就不能反应
(2)物质发生化学变化都伴有能量的变化
(3)伴有能量变化的物质变化都是化学变化
(4)吸热反应和放热反应都有可能自发进行
(5)Na转化为Na+时,吸收的能量就是该过程的反应热
(6)水蒸气变为液态水时放出的能量就是该变化的反应热
| A.(1)(2) | B.(3)(5) | C.(2)(6) | D.(2)(4) |
下列有关吸热反应、放热反应的叙述中,正确的是 ( )
①如果反应物的总能量低于生成物的总能量,该反应一定是吸热反应。
②只要是在加热条件下进行的反应,一定是吸热反应
③只要是在常温常压下进行的反应,一定是放热反应
④中和反应和燃烧反应都是放热反应
⑤化合反应都是放热反应
⑥原电池反应可能是放热反应,也可能是吸热反应
| A.①④ | B.①②③ | C.④⑤⑥ | D.①④⑤⑥ |
反应CO(g)+2H2(g)  CH3OH(g)过程中的能量变化情况如下图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是
CH3OH(g)过程中的能量变化情况如下图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是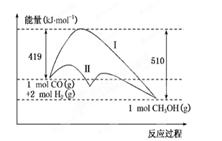
| A.该反应的ΔH=+91 kJ/mol |
| B.加入催化剂,正、逆反应的活化能数值均减小 |
| C.加入催化剂,该反应的ΔH变小 |
| D.如果该反应生成液态CH3OH,则ΔH变大 |
在下列各说法中,正确的是
| A.ΔH >0表示放热反应,ΔH <0表示吸热反应 |
| B.1mol H2SO4与1mol Ba(0H)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| C.1mol H2与0.5mol O2反应放出的热就是H2的燃烧热 |
| D.热化学方程式中的化学计量数只表示物质的量,可以是分数 |
为了测定酸碱中和反应的中和热,计算时至少需要的数据是
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应后溶液的质量
⑤生成水的物质的量 ⑥反应前后溶液温度变化 ⑦操作所需的时间
| A.①②③⑥ | B.①③④⑥ | C.③④⑤⑥ | D.全部 |
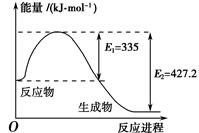
 2NH3(g) ΔH=a kJ·mol-1。
2NH3(g) ΔH=a kJ·mol-1。