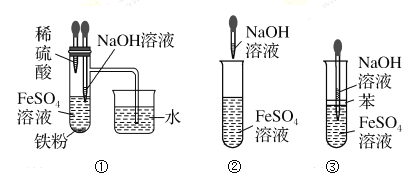
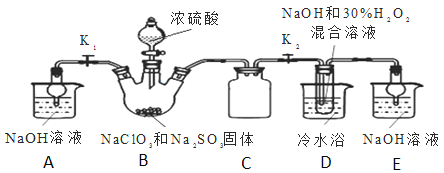
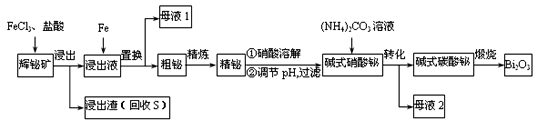
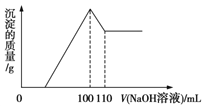
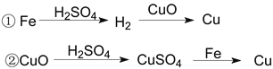题目内容
【题目】工业废弃物的资源化回收再利用,可以更大限度地发挥原材料的价值。下图是工业生产纳米磁性氧化铁的流程:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
下列说法不正确的是
A.用Na2CO3溶液浸泡是为了除去废铁屑表面的油污
B.若生产中不通入N2,暴露在空气中生产,将不能得到高纯度产品
C.加适量的H2O2是为了将部分Fe2+氧化为Fe3+ ,涉及的反应:H2O2+2Fe2++2H+=2Fe3++2H2O
D.溶液A中Fe2+和Fe3+的浓度比为2∶1
【答案】D
【解析】
根据题中磁性氧化铁的流程可知,本题考查四氧化三铁中铁离子和亚铁离子的性质,运用铁离子和亚铁离子的转换方法进行分析。
A. 碳酸钠是强碱弱酸盐水解呈碱性,浸泡废铁屑可以使表面的油脂水解除去,而不能除铁锈,A项正确;
B. 若生成中不通入氮气,暴露在空气中,亚铁离子会被氧化成铁离子,将不能得到高纯度的产品,B项正确;
C. 加入过氧化氢是将亚铁离子氧化成铁离子,1molH2O2得到2mol的电子,所以反应的离子方程式为H2O2+2Fe2++2H+═2Fe3++2H2O,C项正确;
D. 根据最终产物为四氧化三铁,其中Fe2+和Fe3+的数目之比为1:2,所以溶液A中Fe2+和Fe3+的浓度比为1:2,D项错误;
答案选D。

练习册系列答案
 金博士一点全通系列答案
金博士一点全通系列答案
相关题目