题目内容
17.某元素X气态氢化物与该元素最高价氧化物的水化物反应生成盐,则该元素( )| A. | 在周期表中处于第三周期ⅦA族 | B. | 在周期表中处于第2周期ⅤA族 | ||
| C. | 氢化物比H2O稳定 | D. | 常见化合价只有-3、+2、+3、+5价 |
分析 某元素X气态氢化物与该元素最高价氧化物的水化物反应生成盐,则该元素为N元素,据此解答.
解答 解:某元素X气态氢化物与该元素最高价氧化物的水化物反应生成盐,则该元素为N元素,处于于第2周期ⅤA族,非金属性N<O,故氢化物稳定性NH3<H2O,N元素化合价有-3、+1、+2、+3、+4、+5,故选B.
点评 本题考查结构性质位置关系应用,难度不大,注意对基础知识的掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol-1
②N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H3=-483.6kJ•mol-1
下列说法正确的是( )
②N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H3=-483.6kJ•mol-1
下列说法正确的是( )
| A. | 据反应①可知N2的燃烧热为180 kJ•mol-1 | |
| B. | 2H2O(l)═2H2(g)+O2(g)△H>+483.6 kJ•mol-1 | |
| C. | 反应②在恒温恒容密闭容器反应达平衡后,充入N2,平衡正向移动,氮气的转化率减小,该反应的平衡常数增加 | |
| D. | 可推知,氨的催化氧化的热化学方程式为4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=-906 kJ•mol-1 |
20.下列各组物质,两种物质的最简式都为CH2O,且都能发生银镜反应的是( )
| A. | 甲醛和乙醛 | B. | 丙烯醛和苯甲醛 | C. | 乙酸和甲酸甲酯 | D. | 甲醛和葡萄糖 |
5.对四种金属G、L、M、R进行如下实验:
根据表中所给实验结果,判断这四种金属活动性由强到弱的次序正确的是( )
| 实验 金属 | G | L | M | R |
| 和冷水反应 | 无反应 | 慢慢反应 | 未做 | 未做 |
| 和2mol/L HCl 反应 | 溶解并放出气体 | 溶解并放出气体 | 无反应 | 无反应 |
| 和Rn+的水溶液反应 | 溶解并形成沉淀 | 未做 | 溶解并形成沉淀 | 未做 |
| A. | L、G、R、M | B. | G、L、M、R | C. | L、G、M、R | D. | L、R、G、M |
12.减少二氧化碳的排放,氮氧化物、二氧化硫的处理与利用是一项重要的热点课题.
Ⅰ.(1)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H 在0.1MPa时,按n(CO2):n(H2)=1:3投料,图1所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系.
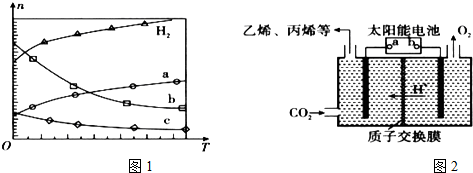
①该反应的△H<0(填“>”、“=”或“<”).
②曲线b表示的物质为H2O.
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是加压(或不断分离出水).
(2)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图2所示.
b为电源的正极,电解时,生成乙烯的电极反应式是2CO2+12e-+12H+=C2H4+4H2O.
Ⅱ.(3)用活性炭还原法可以处理氮氧化物.如反应:C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
①Tl℃时,该反应的平衡常数K=$\frac{9}{16}$.
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是通入一定量的NO;适当缩小容器的体积;增大压强;通入等物质的量的CO2和N2(答一种即可).
Ⅲ.(4)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性.相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是NH4HSO3,用文字和化学用语解释原因HSO3-?H++SO32-,NH4+水解使c(H+)增大,电离平衡逆向移动,c(SO32-)浓度减小.
Ⅰ.(1)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H 在0.1MPa时,按n(CO2):n(H2)=1:3投料,图1所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系.

①该反应的△H<0(填“>”、“=”或“<”).
②曲线b表示的物质为H2O.
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是加压(或不断分离出水).
(2)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图2所示.
b为电源的正极,电解时,生成乙烯的电极反应式是2CO2+12e-+12H+=C2H4+4H2O.
Ⅱ.(3)用活性炭还原法可以处理氮氧化物.如反应:C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是通入一定量的NO;适当缩小容器的体积;增大压强;通入等物质的量的CO2和N2(答一种即可).
Ⅲ.(4)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性.相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是NH4HSO3,用文字和化学用语解释原因HSO3-?H++SO32-,NH4+水解使c(H+)增大,电离平衡逆向移动,c(SO32-)浓度减小.
2.构成下列四种物质的微粒间,既存在离子键又存在共价键的是( )
| A. | MgCl2 | B. | K2S | C. | NaOH | D. | SO3 |
9.下列过程中化学键没有被破坏的是( )
| A. | 水沸腾汽化 | |
| B. | 水加热到1500℃开始分解 | |
| C. | 熔融的氯化钠 | |
| D. | 煤矿中瓦斯(主要成分是甲烷)遇火爆炸 |
6.下列说法或表示方法正确的( )
| A. | 已知C(s)+O2(g)═CO2(g)△H1;C(s)+$\frac{1}{2}$O2(g)═CO (g)△H2,则△H1>△H2 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热大于57.3 kJ | |
| C. | 由C(石墨)═C(金刚石);△H=+1.90kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | 已知氢气的标准燃烧热为-285.8 kJ•mol-1,相应的热化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ•mol-1 |
7.某条件下,一定物质的量的铁和铝分别与足量盐酸反应,若生成气体的体积相同,则铁和铝的用量关系正确的是( )
| A. | 质量比为1:1 | B. | 质量之比为28:9 | ||
| C. | 物质的量之比为2:3 | D. | 物质的量之比为1:1 |