题目内容
【题目】Ⅰ.下表标出的是元素周期表的一部分元素,回答下列问题:
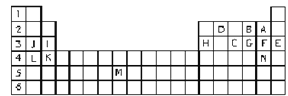
①表中用字母标出的14种元素中,化学性质最不活泼的是____________(用元素符号表示,下同),金属性最强的是____________,常温下单质为液态的非金属元素是____________。
②B、F、C气态氢化物中以________(填分子式)最不稳定。
Ⅱ. 有短周期的A、B、C、D、E 五种元素,它们在周期表的位置如图所示。已知A原子最外层电子数是次外层电子数的2倍。试回答下列问题:
![]()
(1) 元素E在周期表中位于第_______周期_______族。
(2) 元素A的最高价氧化物的电子式为________,元素D的原子结构示意图为________;
(3) 比较C、D两种元素最高价氧化物对应水化物的酸性强弱:______ > ______。(用分子式表示)
(4)元素C的气态氢化物与元素E的最高价氧化物对应水化物化合生成的正盐的化学式为___________,该盐的晶体类型为________。
(5) ①元素B所在周期的简单离子半径最小的是______。(用离子符号表示)
②元素C、D的简单氢化物沸点较高的是______。(用分子式表示)
(6)请用电子式表示Na2S的形成过程____________________________________。
【答案】Ar K Br PH3 三 ⅥA ![]()
![]() HNO3 H3PO4 (NH4)2SO4 离子晶体 Al3+ NH3
HNO3 H3PO4 (NH4)2SO4 离子晶体 Al3+ NH3 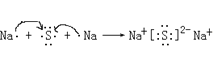
【解析】
Ⅰ. 根据元素周期表知,A、B、C、D、E、F、G、H、I、J、K、L、M、N分别是F、O、P、C、Ar、Cl、S、Al、Mg、Na、Ca、K、Tc、Br元素,以此分析解答;
Ⅱ. A原子最外层电子数是次外层电子数的2倍,A为C,短周期元素的位置关系可知C为N,B为Al,D为P,E为S,以此分析解答。
Ⅰ.①元素周期表中,稀有气体元素原子最外层达到稳定结构,所以化学性质最不活泼,金属性最强的元素位于周期表左下角,非金属性最强的元素位于周期表右上角,但稀有气体除外,常温下单质为液态的非金属元素是Br,所以这14种元素中,化学性质最不活泼的元素是Ar,金属性最强的元素是K,
因此,本题正确答案是:Ar ;K;Br;
②元素的非金属性越弱,其氢化物越不稳定,O、Cl、P这三种元素非金属性最弱的是P,则PH3最不稳定,
因此,本题正确答案是:PH3。
Ⅱ. A原子最外层电子数是次外层电子数的2倍,A为C,短周期元素的位置关系可知C为N,B为Al,D为P,E为S,
(1) E是S在周期表中位于第三周期ⅥA族。
因此,本题正确答案是:三;ⅥA;
(2) 元素A的最高价氧化物是CO2,电子式为![]() ,D是P,原子结构示意图为
,D是P,原子结构示意图为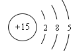 ;
;
因此,本题正确答案是:![]() ;
;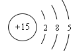 ;
;
(3) C为N,D为P,N和P位于同一主族,非金属性N>P,则两种元素最高价氧化物对应水化物的酸性强弱:HNO3 > H3PO4;
因此,本题正确答案是:HNO3 ;H3PO4;
(4)C为N,N的气态氢化物为NH3,E为S,S的最高价氧化物对应水化物为H2SO4,NH3和H2SO4化合生成的正盐的化学式为(NH4)2SO4,其晶体类型为离子晶体,
因此,本题正确答案是:(NH4)2SO4;离子晶体;
(5) ①B为Al,Al位于第三周期,第三周期的简单离子半径最小的是Al3+;
②C为N,D为P,N和P位于同一主族,由于NH3分子间存在氢键,则简单氢化物沸点较高的是NH3;
因此,本题正确答案是:Al3+;NH3;
(6) Na2S为离子化合物,一个钠原子失一个电子,一个硫原子得两个电子,用电子式表示Na2S的形成过程为: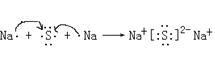 ;
;
因此,本题正确答案是: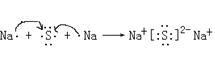 。
。

 名校课堂系列答案
名校课堂系列答案【题目】800℃时,在2L的密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2,n(NO)随时间的变化如下表所示。
2NO2,n(NO)随时间的变化如下表所示。
时间∕s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)∕mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)从0~3s内,用NO表示的平均反应速率υ(NO)=_____________。
(2)图中表示NO浓度变化的曲线是_______(填字母代号)。
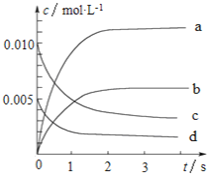
(3)达平衡时NO的转化率为________。
(4)能说明该反应已达到平衡状态的是_________(填序号)。
A.混合气体的颜色保持不变
B.混合气体的密度保持不变
C.υ逆 (NO2)=2υ正 (O2)
D.混合气体的平均相对分子质量保持不变
(5)若升温到850℃,达平衡后n(NO)=n(NO2),则反应向________(填“正反应方向”、“逆反应方向”)移动。
(6)若在一定条件下0.2molNO气体与氧气反应,达平衡时测得放出的热量为akJ,此时NO转化率为80%,则2molNO气体完全反应放出的热量为____________。
【题目】工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:
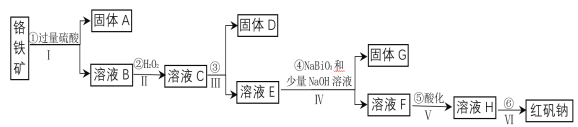
查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42-。
ii.
物质 | 开始沉淀的pH | 完全沉淀的pH |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.4 | 4.4 |
Cr(OH)3 | 4.6 | 5.9 |
Fe(OH)2 | 7.5 | 9.7 |
Bi(OH)3 | 0.7 | 4.5 |
回答下列问题:
(1)固体A的成分是____________。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和_______ 、______(填仪器名称)。
(3)③为加入物质来调节溶液的pH,则pH的合适范围是_______ 。
(4)写出④反应的离子方程式_____________________________。
(5)⑤中酸化是使CrO42-转化为Cr2O72-写出该反应的离子方程式_________________。
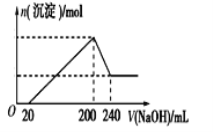
(6)取一定质量的固体D溶解于200 mL的稀硫酸中,向所得溶液中加入5.0 mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为_________,固体D中含Fe化合物的物质的量为___________。
【题目】下列物质的分类正确的是( )
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | Na2CO3 | H2SO4 | Cu2(OH)2CO3 | Fe2O3 | SO3 |
B | NaOH | HCl | NaCl | Na2O2 | CO |
C | NaOH | NaHSO4 | CaF2 | MgO | SO2 |
D | KOH | HNO3 | NaHCO3 | CaO | CO2 |
A.AB.BC.CD.D