题目内容
【题目】工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:
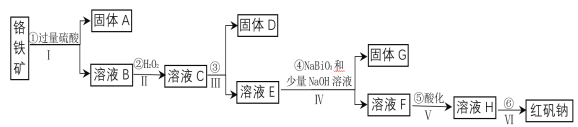
查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42-。
ii.
物质 | 开始沉淀的pH | 完全沉淀的pH |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.4 | 4.4 |
Cr(OH)3 | 4.6 | 5.9 |
Fe(OH)2 | 7.5 | 9.7 |
Bi(OH)3 | 0.7 | 4.5 |
回答下列问题:
(1)固体A的成分是____________。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和_______ 、______(填仪器名称)。
(3)③为加入物质来调节溶液的pH,则pH的合适范围是_______ 。
(4)写出④反应的离子方程式_____________________________。
(5)⑤中酸化是使CrO42-转化为Cr2O72-写出该反应的离子方程式_________________。
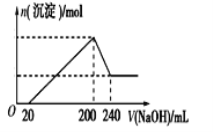
(6)取一定质量的固体D溶解于200 mL的稀硫酸中,向所得溶液中加入5.0 mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为_________,固体D中含Fe化合物的物质的量为___________。
【答案】SiO2漏斗烧杯4.4-4.63NaBiO3 + 2Cr3++ 7OH-+ H2O = 2CrO42-+ 3Na+ +3Bi(OH)3↓2CrO42-+2H+ ![]() Cr2O72-+H2O2.5mol·L-1 0.10mol
Cr2O72-+H2O2.5mol·L-1 0.10mol
【解析】
由流程图可知,铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)加过量硫酸FeO、Cr2O3和Al2O3都溶解,SiO2不溶,经过滤分离得到固体A和溶液B,则固体A为SiO2;溶液B中含有Fe2+、Al3+、Cr3+,加入H2O2目的是将Fe2+氧化为Fe3+,第③步是调溶液pH,使Fe3+形成氢氧化铁沉淀,同时Al3+变成氢氧化铝沉淀而除去,固体D为氢氧化铁和氢氧化铝混合物;第④步加入NaBiO3和少量NaOH溶液将Cr3+转化为CrO42-;第⑤步中酸化是使CrO42-转化为Cr2O72-;第⑥步经蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠,据此分析。
(1)根据以上分析,固体A的成分是SiO2,
因此,本题正确答案为:SiO2;
(2)操作Ⅰ、Ⅲ、Ⅳ均是过滤,则用到的主要玻璃仪器有玻璃棒和漏斗、烧杯,
因此,本题正确答案为:漏斗 ;烧杯;
(3)从氢氧化物形成沉淀的pH表格可知,③为加入物质来调节溶液的pH,使Fe3+和Al3+沉淀,而Cr3+不沉淀,则pH的合适范围是4.4-4.6,
因此,本题正确答案为:4.4-4.6;
(4)常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-,则反应④的离子方程式为:3NaBiO3 + 2Cr3++ 7OH-+ H2O = 2CrO42-+ 3Na+ +3Bi(OH)3↓ ,
因此,本题正确答案为:3NaBiO3 + 2Cr3++ 7OH-+ H2O = 2CrO42-+ 3Na+ +3Bi(OH)3↓;
(5)⑤中酸化是使CrO42-转化为Cr2O72-,在转化过程中元素化合价不变,则该反应的离子方程式为2CrO42-+2H+ ![]() Cr2O72-+H2O,
Cr2O72-+H2O,
因此,本题正确答案为:2CrO42-+2H+ ![]() Cr2O72-+H2O;
Cr2O72-+H2O;
(6)根据图像可知加入氢氧化钠时没有立即产生沉淀,这说明酸过量,首先发生酸碱中和。当沉淀不再发生变化时需要氢氧化钠是200mL,继续加入氢氧化钠沉淀开始减小,即氢氧化铝开始溶解,溶解氢氧化铝消耗的氢氧化钠溶液是40mL,则生成氢氧化铝消耗的氢氧化钠溶液体积是120mL,所以与铁离子反应的氢氧化钠溶液体积是200mL-20mL -120mL=60mL,物质的量是5.0mol/L×0.06L=0.3mol,所以根据方程式Fe3++3OH-=Fe(OH)3↓,所以铁离子是0.1mol。
沉淀达到最大值时溶液中的溶质是硫酸钠,则根据原子守恒可知硫酸钠的物质的量是![]() =0.5mol,则硫酸的浓度是
=0.5mol,则硫酸的浓度是![]() =2.5mol/L。
=2.5mol/L。
因此,本题正确答案为:2.5mol·L-1 ;0.10mol。