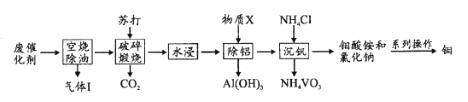
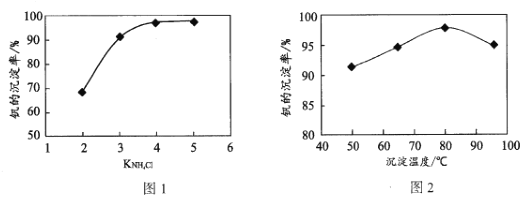
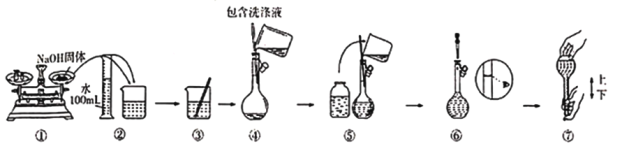
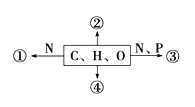
题目内容
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.等体积的CO2和CO,分子数目均为NA
B.常温下pH=12的NaOH溶液中,水电离出的氢离子数为10-12NA
C.标准状况下,22.4L的H2和22.4L的F2混合后,气体分子数为2NA
D.H2O(g)通过足量Na2O2(s)充分反应,固体增重bg时,反应中转移的电子数为bNA/2
【答案】D
【解析】
A.未指明温度和压强,若二者所处温度和压强不同,等体积的CO2和CO所含分子数不同,且体积、物质的量均未知,也不能确定分子数目,故A错误;
B.溶液体积未知,无法计算微粒数目,故B错误;
C.标准状况下,22.4L的H2和22.4L的F2混合后二者反应生成2molHF,但是标况下HF不是气体,故C错误;
D.根据方程式2H2O+2Na2O2=4NaOH+O2可知,固体增重质量即为水中氢元素的质量,固体增重bg时参与反应的水的物质的量为![]() mol,根据方程式可知转移的电子为
mol,根据方程式可知转移的电子为![]() mol,数目为
mol,数目为![]() NA,故D正确;
NA,故D正确;
故答案为D。

【题目】温度为T 时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,
反应:PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 250 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s内的平均速率v(PCl3)=0.0032mol/(L·s)
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,该反应为放热反应
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前的v正>v逆
D. 相同温度下,起始时向容器中充入2.0 mol PCl3、2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%