题目内容
已知2SO2 (g)+O2 (g)  2SO3 (g);△H =﹣197kJ?mol﹣1,向同温、同体积的三个密闭容器中分别充入气体,起始投料量如下表:
2SO3 (g);△H =﹣197kJ?mol﹣1,向同温、同体积的三个密闭容器中分别充入气体,起始投料量如下表:
| | SO2 (mol) | O2 (mol) | SO3 (mol) |
| 甲 | 2 | 1 | 0 |
| 乙 | 4 | 2 | 0 |
| 丙 | 0 | 0 | 2 |
恒温、恒容下反应达平衡时,下列关系一定正确的是
A.SO3的质量m:2m甲 = m乙
B.容器内压强P:2P丙 > P乙
C.反应放出或吸收热量的数值Q:Q甲 > Q丙
D.c(SO2)与c(O2)之比a:a丙 > a乙
B
解析试题分析:A、因为反应同温、同体积,所以乙中压强大于甲中压强,平衡向右移动,所以SO3的质量:2m甲 < m乙,错误;B、乙容器的压强大于丙容器的压强,乙反应更有利于向右移动,所以容器内压强:2P丙 > P乙,正确;C、甲与丙内加入的物质等效,因为反应进行的程度不确定,所以反应放出或吸收热量的数值不能确定,错误;D、三容器内c(SO2)与c(O2)之比均为2:1,错误。
考点:本题考查化学平衡移动及应用。

练习册系列答案
相关题目
一定条件下,可逆反应:X(g) + 3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),反应达到平衡时, X、Y、Z的浓度分别为0.1mol?L-1、0.3 mol?L-1、0.08 mol?L-1,则下列判断不正确的是 ( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),反应达到平衡时, X、Y、Z的浓度分别为0.1mol?L-1、0.3 mol?L-1、0.08 mol?L-1,则下列判断不正确的是 ( )
| A.c1∶c2="=" 1∶3 | B.平衡时,Y和Z生成速率之比为3∶2 |
| C.X、Y的转化率不相等 | D.c1的取值范围为0< c1< 0.14 mol?L-1 |
现有可逆反应:X(g)+Y(g) 2Z(g)+W(s)
2Z(g)+W(s) H<0,下图a曲线表示X的转化率随时间的变化关系。若改变起始条件使反应按b曲线进行,可采取的措施是
H<0,下图a曲线表示X的转化率随时间的变化关系。若改变起始条件使反应按b曲线进行,可采取的措施是
| A.降低温度 | B.增大Y的浓度 | C.加入催化剂 | D.增大容器的体积 |
已知X(g)+3Y(g)═ 2Z(g)△H>0,下列对该反应的说法中正确的是
| A.△S>0 |
| B.逆向能自发进行,且反应速率和平衡常数均较大 |
| C.反应物总能量大于生成物总能量 |
| D.在任何温度下都不能自发进行 |
一定条件下,对于可逆反应X(g)+3Y(g)  2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是
| A.c1∶c2=3∶1 | B.平衡时,Y和Z的生成速率之比为2∶3 |
| C.X、Y的转化率相等 | D.c1的取值范围为0.04 mol/L<c1<0.14 mol/L |
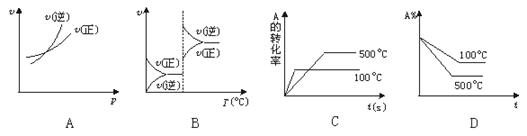
 2C(g)(正反应吸热),下列图象中正确的是
2C(g)(正反应吸热),下列图象中正确的是