题目内容
某温度下,在容积固定的密闭容器中,发生可逆反应中A(g)+2B(g) 2Q(g)
2Q(g)
平衡时,各物质的浓度比为c(A):c(B):c(Q)=1:1:2,保持温度不变,以1:1:2的体积比再充入A、B、Q(相当加压),则下列叙述正确的是
A.刚充入时反应速率:v(正)减小,v(逆)增大
B.达到新的平衡时:反应混合物中A.B的体积分数增加
C. 达到新的平衡时:c(A):c(B):c(Q)仍为1:1:2
D. 达到新的平衡过程中:体系压强先增大,后减小
D
解析试题分析:A、刚充入时相当于增大压强,正逆反应的速率都增大,错误;B、增大压强,平衡正向移动,A、B的体积分数减小,错误;C、由于平衡发生了移动,所以再达平衡时各物质的物质的量浓度之比发生变化,不是1:1:2,错误;D、刚充入时体系的压强增大,随着反应的正向进行,是体系的压强逐渐减小,所以压强是先增大后减小,正确,答案选D。
考点:考查化学平衡移动的判断,反应速率的变化与条件改变的关系

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
在一定温度下,容器内某一反应中两种气态物质M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
A.反应的化学方程式为:2M N N |
| B.t2时,正逆反应速率相等,反应达到平衡状态 |
| C.t3时,M上a点正反应速率等于N上b点的逆反应速率 |
D. 混一定时,N的体积百分含量也一定 混一定时,N的体积百分含量也一定 |
对于反应 A + B  C,下列条件的改变一定能使化学反应加快的是
C,下列条件的改变一定能使化学反应加快的是
| A.升高体系的温度 | B.增加A的物质的量 |
| C.减少C的物质的量 | D.增大体系的压强 |
已知2SO2 (g)+O2 (g)  2SO3 (g);△H =﹣197kJ?mol﹣1,向同温、同体积的三个密闭容器中分别充入气体,起始投料量如下表:
2SO3 (g);△H =﹣197kJ?mol﹣1,向同温、同体积的三个密闭容器中分别充入气体,起始投料量如下表:
| | SO2 (mol) | O2 (mol) | SO3 (mol) |
| 甲 | 2 | 1 | 0 |
| 乙 | 4 | 2 | 0 |
| 丙 | 0 | 0 | 2 |
恒温、恒容下反应达平衡时,下列关系一定正确的是
A.SO3的质量m:2m甲 = m乙
B.容器内压强P:2P丙 > P乙
C.反应放出或吸收热量的数值Q:Q甲 > Q丙
D.c(SO2)与c(O2)之比a:a丙 > a乙
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO +3HSO
+3HSO ===3SO
===3SO +Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快。下图为用ClO
+Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快。下图为用ClO 在单位时间内的物质的量浓度的变化来表示该反应的速率一时间图象。下列说法不正确的是( )
在单位时间内的物质的量浓度的变化来表示该反应的速率一时间图象。下列说法不正确的是( )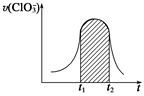
| A.反应开始时速率增大可能是c(H+)增大引起的 |
| B.纵坐标为v(H+)的速率—时间曲线与图中曲线能完全重合 |
| C.后期反应速率下降的主要原因是反应物的浓度减小 |
D.图中的阴影部分“面积”为t1~t2时间内ClO 的物质的量浓度的减小值 的物质的量浓度的减小值 |
下列说法正确的是
| A.增大压强,使单位体积内活化分子数目增加,化学反应速率一定增大 |
| B.升高温度,使活化分子百分数增加,化学反应速率一定增大 |
| C.活化分子间所发生的分子间的碰撞均为有效碰撞 |
| D.加入反应物,使活化分子百分数增加,化学反应速率一定增大 |
下列措施对增大反应速率明显有效的是( )
| A.Na与无水乙醇反应时增大无水乙醇的用量 |
| B.Zn与25%的稀硫酸反应制取H2时,改用98%的浓硫酸 |
| C.在K2SO4与BaCl2两溶液反应时,增大压强 |
| D.将炭块磨成炭粉用于燃烧 |
 2NH3(g) △H="—92.4" KJ/mol。在一恒温恒压的密闭容器里充入2mol N2和8mol H2达到平衡时生成1 mol NH3。现在相同条件下的同一容器中充入x mol N2,y mol H2和2 mol NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2KJ。则x、y的值分别为( )
2NH3(g) △H="—92.4" KJ/mol。在一恒温恒压的密闭容器里充入2mol N2和8mol H2达到平衡时生成1 mol NH3。现在相同条件下的同一容器中充入x mol N2,y mol H2和2 mol NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2KJ。则x、y的值分别为( ) 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是
2C的反应来说,以下化学反应速率的表示中,反应速率最快的是