题目内容
8.(1)人类可以主动参与氮循环,合成氨工业就是参与的手段之一.以天然气为原料合成氨是新的生产氮肥的方法,它具有污染小、成本低等诸多优点. 其过程大体如图1所示:
①请写出用天然气制备氢气的化学方程式:CH4+2H2O$\frac{\underline{\;催化剂\;}}{\;}$CO2+4H2.
②写出合成尿素反应的化学方程式:CO2+2NH3$\frac{\underline{\;一定条件\;}}{\;}$CO(NH2)2+H2O.
③写出O2与NH3反应生成NH4NO3和H2O的化学方程式:2NH3+2O2$\frac{\underline{\;催化剂\;}}{\;}$NH4NO3+H2O.
④每生产1mol NH4NO3最少需要NH32mol,而要生产这些NH3又最少需要CH40.75mol.
(2)科学家已获得极具理论研究意义的N4分子,其结构为正四面体(如图2).已知断裂1molN-N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则1molN4气体转化为N2时要释放724kJ能量.
分析 (1)①根据工艺流程示意图可知CH4的转化为CO2和H2;②根据二氧化碳和氨气反应生成尿素;③根据原子守恒写出O2与NH3反应生成NH4NO3和H2O的化学方程式;④根据氮原子守恒回答;
(2)从结构图中可看出,一个N4分子中含有6个N-N键,根据反应热等于反应物的总键能减生成物的总键能计算.
解答 解:(1)①CH4转化过程中生成了CO2和H2,方程式为:CH4+2H2O$\frac{\underline{\;催化剂\;}}{\;}$CO2+4H2,
故答案为:CH4+2H2O$\frac{\underline{\;催化剂\;}}{\;}$CO2+4H2;
②二氧化碳和氨气反应生成尿素,根据原子守恒:CO2+2NH3$\frac{\underline{\;一定条件\;}}{\;}$CO(NH2)2+H2O,
故答案为:CO2+2NH3$\frac{\underline{\;一定条件\;}}{\;}$CO(NH2)2+H2O;
③O2与NH3反应生成NH4NO3,根据原子守恒反应的化学方程式为2NH3+2O2$\frac{\underline{\;催化剂\;}}{\;}$NH4NO3+H2O,
故答案为:2NH3+2O2$\frac{\underline{\;催化剂\;}}{\;}$NH4NO3+H2O;
④NH4NO3~2NH3,每生产1mol NH4NO3最少需要2molNH3;根据反应CH4+2H2O$\frac{\underline{\;催化剂\;}}{\;}$CO2+4H2、N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,可知生产2molNH3需要甲烷0.75mol,
故答案为:2;0.75;
(2)从结构图中可看出,一个N4分子中含有6个N-N键,根据反应热等于反应物的总键能减生成物的总键能,则N4(g)=2N2(g)△H,有△H=6×193 kJ•mol-1-2×941 kJ•mol-1=-724 kJ•mol-1,
故答案为:724.
点评 本题是一道化学和工业生成相结合的题目,涉及到氧化还原反应、方程式的书写、电解原理、反应热的计算,考查学生分析和解决问题的能力,题目难度中等.

| A. | SF6 | B. | BeCl2 | C. | CO2 | D. | PCl5 |
| A. | A>B>C>D | B. | A>C>B>D | C. | A>C>D>B | D. | B>D>C>A |
| A. | 离子晶体的晶格能是气态离子形成1mol晶胞时放出的能量 | |
| B. | 金属的六方最密堆积和面心立方最密堆积的空间利用率最高 | |
| C. | 钠晶胞结构如图 ,钠晶胞中每个钠原子的配位数为8 ,钠晶胞中每个钠原子的配位数为8 | |
| D. | 温度升高,金属的导电性将变弱 |
(1)已知:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是AD.
A.升高温度B.增加碳的用量C.加入催化剂D.用储氢金属吸收H2

(2)某些合金可用于储存氢,金属储氢的原理可表示为:M(s)+xH2(g)?MH2(s)△H<0(M表示某种合金).如图1表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系,则T1<T2(填“<”、“>”或“=”).
(3)某温度下,在2L体积不变的密闭容器中将1molCO和2molH2混合发生反应:CO(g)+2H2(g)?CH3OH(g),测得不同时刻的反应前后压强关系如表:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比($\frac{{P}_{后}}{{P}_{前}}$) | 0.98 | 0.90 | 0.78 | 0.66 | 0.66 | 0.66 |
(4)CO可以还原某些金属氧化物生成金属单质和CO2,如图2是四种金属氧化物被CO还原时1g[$\frac{c(CO)}{c(C{O}_{2})}$)]与温度(T)的关系曲线图.
①其中最易被还原的金属氧化物是Cu2O(填化学式).
②700℃时CO还原Cr2O3反应中的平衡常数k=10-12.
(5)水煤气处理后,获得的较纯H2用于合成氨:N2(g)+3H2(g)?2NH3(g),△H=-92.4kJ•mol-1.如图3为不同实验条件下进行合成氨反应实验,N2浓度随时间变化示意图.
①与实验Ⅰ比较,实验Ⅱ改变的条件为使用催化剂.
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在图4中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图
 .
.(6)饮用水中的NO3-主要来自于NH4+,已知在微生物作用下,NH4+经过两步反应被氧化成NO3-,两步反应的能量变化示意图如图5.请写出1molNH4+(aq)的热化学方程式NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol.

 .
. .
.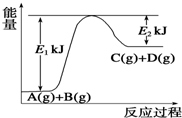 已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.
已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题. 和
和 两种结构式互为同分异构体(a、b为不同的原子或原子团),被称为烯烃的顺反异构,试推断一氯丙烯的同分异构体(不含环状结构)共有( )
两种结构式互为同分异构体(a、b为不同的原子或原子团),被称为烯烃的顺反异构,试推断一氯丙烯的同分异构体(不含环状结构)共有( )