题目内容
6.将水蒸气通过红热的碳可产生水煤气,以此产物为原料可生产多种产品.(1)已知:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是AD.
A.升高温度B.增加碳的用量C.加入催化剂D.用储氢金属吸收H2
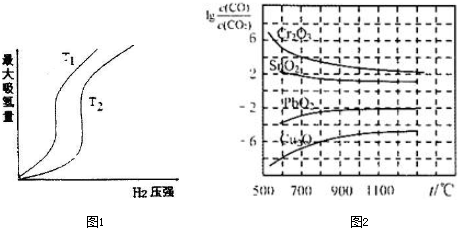
(2)某些合金可用于储存氢,金属储氢的原理可表示为:M(s)+xH2(g)?MH2(s)△H<0(M表示某种合金).如图1表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系,则T1<T2(填“<”、“>”或“=”).
(3)某温度下,在2L体积不变的密闭容器中将1molCO和2molH2混合发生反应:CO(g)+2H2(g)?CH3OH(g),测得不同时刻的反应前后压强关系如表:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比($\frac{{P}_{后}}{{P}_{前}}$) | 0.98 | 0.90 | 0.78 | 0.66 | 0.66 | 0.66 |
(4)CO可以还原某些金属氧化物生成金属单质和CO2,如图2是四种金属氧化物被CO还原时1g[$\frac{c(CO)}{c(C{O}_{2})}$)]与温度(T)的关系曲线图.
①其中最易被还原的金属氧化物是Cu2O(填化学式).
②700℃时CO还原Cr2O3反应中的平衡常数k=10-12.
(5)水煤气处理后,获得的较纯H2用于合成氨:N2(g)+3H2(g)?2NH3(g),△H=-92.4kJ•mol-1.如图3为不同实验条件下进行合成氨反应实验,N2浓度随时间变化示意图.
①与实验Ⅰ比较,实验Ⅱ改变的条件为使用催化剂.
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在图4中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图
 .
.(6)饮用水中的NO3-主要来自于NH4+,已知在微生物作用下,NH4+经过两步反应被氧化成NO3-,两步反应的能量变化示意图如图5.请写出1molNH4+(aq)的热化学方程式NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol.

分析 (1)达到平衡后,体积不变时,能提高H2O的平衡转化率,应使平衡向正反应方向移动;
(2)在压强相同的条件下,T1对应的吸氢量大,也就是T2→T1,平衡正向移动,而正反应是放热反应;
(3)温度、体积不变的可逆反应中,气体的压强之比等于其物质的量之比,据此计算反应后气体体积的物质的量,从而计算氢气反应的物质的量,再根据v=$\frac{\frac{△n}{V}}{△t}$计算反应速率;根据CO反应的物质的量计算其转化率,化学反应速率概念计算v=$\frac{△c}{△t}$计算得到;转化率=$\frac{消耗量}{起始量}$×100%;
(4)K越大,说明反应进行的程度大,金属氧化物越易被还原;700℃时CO还原Cr2O3反应为:Cr2O3+3CO?2Cr+3CO2,lg($\frac{1}{K}$)${\;}^{\frac{1}{3}}$=4,所以K=10-12;
(5)①由图开始,实验Ⅱ与实验Ⅰ相比,反应速率加快,平衡时氮气的浓度不变,说明改变条件速率加快平衡不移动,结合反应特征与平衡移动原理分析;
②实验Ⅲ的温度比实验Ⅰ高,反应速率快,到达平衡时间缩短,正反应为放热反应,平衡向逆反应方向移动,平衡时氨气的浓度较实验Ⅰ低,据此作图;
(6)结合图象根据盖斯定律来计算反应的焓变.
解答 解:(1)达到平衡后,体积不变时,能提高H2O的平衡转化率,应使平衡向正反应方向移动,A.升高温度,平衡向吸热方向移动,故正确;
B.增加碳的用量,平衡都不移动,故错误;
C.加入催化剂,平衡都不移动,故错误;
D.用储氢金属吸收H2,减少生成物的浓度平衡正向移动,故正确;
故选AD;
(2)在压强相同的条件下,T1对应的吸氢量大,也就是T2→T1,平衡正向移动,而正反应是放热反应,所以T2→T1,是降温,所以T2>T1,故答案为:<;
(3)温度、体积不变的可逆反应中,气体的压强之比等于其物质的量之比,10min,压强比(P后/P前)=0.9,则反应后气体的物质的量=3mol×0.9=2.7mol,气体减少的物质的量=3mol-2.7mol=0.3mol,根据气体减少的物质的量与氢气之间的关系式知,参加反应的氢气的物质的量=$\frac{0.3}{2}×2$=0.3mol,0~10min,用H2表示的平均反应速率=$\frac{\frac{0.3}{2}}{10}$mol•L-1•min-1=0.015 mol•L-1•min-1;
平衡状态压强比(P后/P前)=0.66,则反应后气体的物质的量=3mol×0.66=1.98mol,气体减少的物质的量=3mol-1.98mol=1.02mol,根据气体减少的物质的量与氢气之间的关系式知参加反应的CO的物质的量$\frac{1.02mol}{2}$=0.51mol,则CO的转化率=$\frac{0.51mol}{1mol}$×100%=51%,
故答案为:0.015 mol•L-1•min-1;51%;
(4)K越大,金属氧化物越易被还原,故Cu2O越易被还原;700℃时CO还原Cr2O3反应为:Cr2O3+3CO?2Cr+3CO2,lg($\frac{1}{K}$)${\;}^{\frac{1}{3}}$=4,所以K=10-12,故答案为:①Cu2O;②10-12;
(5)①由图开始,实验Ⅱ与实验Ⅰ相比,反应速率加快,平衡时氮气的浓度不变,说明改变条件速率加快平衡不移动,该反应正反应是体积减小的放热反应,升高温度或增大压强、增大反应物浓度,可以增大反应速率,但平衡发生移动,故应是使用催化剂,
故答案为:使用催化剂;
②实验Ⅲ的温度比实验Ⅰ高,反应速率快,到达平衡时间缩短,正反应为放热反应,平衡向逆反应方向移动,平衡时氨气的浓度较实验Ⅰ低,故图象为: ,
,
故答案为: ;
;
(6)第一步的热化学方程式为NH4+(aq)+1.5O2(g)═NO2-(aq)+2H+(aq)+H2O(l),△H=-273KJ/mol,
第二步的热化学方程式为:NO2-(aq)+0.5O2(g)═NO3-(aq),△H=-73KJ/mol,
根据盖斯定律则NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol,
故答案为:NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol.
点评 题目综合性较大,涉及反应热计算、盖斯定律的应用、电极反应式书写、化学平衡的移动、化学平衡图象与影响因素、化学平衡常数计算等,侧重高考常考点与基础知识的考查,目难度较大.

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案| A. | CH3CH2OH→CH3CHO | B. | Fe2O3→Fe(OH)3 | C. | SiO2→H2SiO3 | D. | Al2O3→Al(OH)3 |
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O△H=-Q kJ/mol(Q>0) |
| A. | 80ml | B. | 120ml | C. | 150ml | D. | 200ml |
| A | B |
| ①由C、H两种元素组成; ②能使溴的四氯化碳溶液褪色; ③比例模型为:  | ①由C、H两种元素组成; ②球棍模型为: 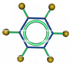 |
(1)A与溴的四氯化碳溶液反应的生成物的名称是1,2-二溴乙烷.
(2)A与氢气发生加成反应后生成分子C,C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体②有毒③不溶于水④密度比水大⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应;在浓硫酸作用下,B与浓硝酸反应的化学方程式是
 .
. | A. | 第三周期第0族 | B. | 第三周期第ⅦA族 | C. | 第三周期第ⅠA族 | D. | 第ⅠA族第四周期 |
 ;B的结构简式为
;B的结构简式为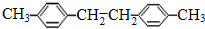 ;与A含有相同种类和数目的官能团(包括苯环)、且苯环上取代基位置和数量也相同的同分异构体有多种,写出其中任意一种的结构简式
;与A含有相同种类和数目的官能团(包括苯环)、且苯环上取代基位置和数量也相同的同分异构体有多种,写出其中任意一种的结构简式 (不包括原化合物,不考虑立体异构).
(不包括原化合物,不考虑立体异构).