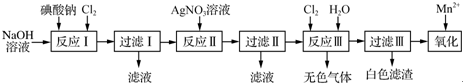
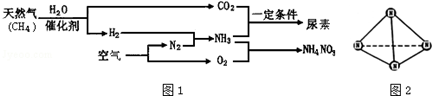
题目内容
18.下列分子中所有原子均满足最外层8电子结构的是( )| A. | SF6 | B. | BeCl2 | C. | CO2 | D. | PCl5 |
分析 对于ABn的共价化合物,各元素满足|化合价|+元素原子的最外层电子数=8,原子都满足最外层8电子结构,据此结合选项判断.
解答 解:A、SF6中,S元素位于第ⅥA族,则6+6≠8,不满足分子中所有原子都满足最外层8电子结构,故A不符合;
B、BeCl2中Be元素化合价为+2,Be原子最外层电子数为2,所以2+2=4,分子中Be原子不满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以|-1|+7=8,分子中Cl原子满足8电子结构,故B不符合;
C、CO2中C元素化合价为+4,C原子最外层电子数为4,所以4+4=8,分子中C原子满足8电子结构;O元素化合价为-2,O原子最外层电子数为6,所以|-2|+6=8,分子中O原子满足8电子结构,故C符合;
D、PCl5中P元素化合价为+5,P原子最外层电子数为5,所以5+5=10,分子中P原子不满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以|-1|+7=8,分子中Cl原子满足8电子结构,故D不符合;
故选C.
点评 本题考查分子8电子结构判断,难度不大,侧重考查对共价键的理解,掌握判断规律|化合价|+元素原子的最外层电子数=8,满足最外层8电子结构,注意分子有H原子一定不满足8电子结构.

练习册系列答案
 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
8.用分液漏斗可以分离的一组混合物是( )
| A. | 溴苯和水 | B. | 丙醇和乙二醇 | C. | 碘和乙醇 | D. | 甘油和水 |
9.元素性质呈周期性变化的决定因素是( )
| A. | 元素原子半径大小呈周期性变化 | |
| B. | 元素原子量依次递增 | |
| C. | 元素的最高正化合价呈周期性变化 | |
| D. | 元素原子最外层电子排布呈周期性变化 |
6.下列反应中,不属于氧化还原反应的是( )
| A. | 2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$ 2H2O+O2↑ | |
| B. | NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ | |
| C. | 2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3 | |
| D. | Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O |
13.少量铁粉与100mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率可以使用如下方法( )
| A. | 加H2O | B. | 滴入几滴浓盐酸 | ||
| C. | 增大压强 | D. | 升高温度(不考虑盐酸挥发) |
3. 与等物质的量的Br2发生加成反应,生成的产物是( )
与等物质的量的Br2发生加成反应,生成的产物是( )
 与等物质的量的Br2发生加成反应,生成的产物是( )
与等物质的量的Br2发生加成反应,生成的产物是( )| A. | 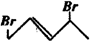 | B. | 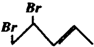 | C. |  | D. | 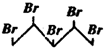 |
10.下列按纯净物、混合物、电解质、非电解质顺序排列的是( )
| A. | 盐酸、空气、醋酸、干冰 | B. | 冰醋酸、碱石灰、硫酸钠、乙醇 | ||
| C. | 蛋白质、油脂、苛性钠、石灰石 | D. | 胆矾、漂白粉、氯化钾、硫酸钡 |