题目内容
16.把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池.A、B相连时,A为负极;C、D相连时,D上有气泡逸出;A、C相连时,A极减轻;B、D相连时,B为正极.则四种金属的活动性顺序由大到小排列为( )| A. | A>B>C>D | B. | A>C>B>D | C. | A>C>D>B | D. | B>D>C>A |
分析 一般来说,在原电池中,作负极的金属其金属活动性大于作正极的金属,失电子发生氧化反应的金属作负极、得电子发生还原反应的金属作正极,据此判断金属性强弱顺序.
解答 解:一般来说,在原电池中,作负极的金属其金属活动性大于作正极的金属,失电子发生氧化反应的金属作负极、得电子发生还原反应的金属作正极,
A、B相连时,A为负极,则金属活动性顺序A>B;
C、D相连时,D上有气泡逸出,说明D上得电子发生还原反应,则金属活动性C>D;
A、C相连时,A极减轻,说明A失电子发生氧化反应,则金属活动性A>C;
B、D相连时,B为正极,则金属活动性D>B,
所以这几种金属活动性顺序是A>C>D>B,故选C.
点评 本题以原电池原理为载体考查金属活动性强弱判断,正确判断原电池正负极是解本题关键,可以根据反应类型、电子流向、电流流向、电解质溶液中阴阳离子移动方向、金属电极材料质量变化、得失电子等方面判断,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.下列反应中,不属于氧化还原反应的是( )
| A. | 2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$ 2H2O+O2↑ | |
| B. | NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ | |
| C. | 2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3 | |
| D. | Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O |
11.下列事实能说明亚硝酸是弱电解质的是( )
①25℃时亚硝酸钠溶液的pH大于7
②用HNO2溶液做导电试验,灯泡很暗
③HNO2溶液不与Na2SO4溶液反应
④0.1mol•L-1 HNO2溶液的pH=2.1.
①25℃时亚硝酸钠溶液的pH大于7
②用HNO2溶液做导电试验,灯泡很暗
③HNO2溶液不与Na2SO4溶液反应
④0.1mol•L-1 HNO2溶液的pH=2.1.
| A. | ①②③ | B. | ②③④ | C. | ①④ | D. | ①②④ |
5.可用一种试剂鉴别KCl、Ba(OH)2、Na2CO3、K2SO3四种溶液,该试剂是( )
| A. | BaCl2 | B. | H2SO4 | C. | KOH | D. | HCl |
6.下列物质之间的转化,能一步完成的是( )
| A. | CH3CH2OH→CH3CHO | B. | Fe2O3→Fe(OH)3 | C. | SiO2→H2SiO3 | D. | Al2O3→Al(OH)3 |
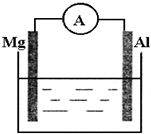 如图所示装置
如图所示装置