题目内容
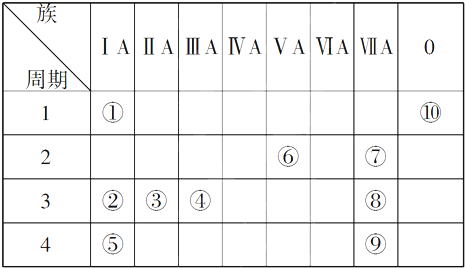
10.下图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 .
.(2)得电子能力最强的是F 地壳中含量最多的金属元素是Al.
(3)用电子式表示②与④形成化合物的过程
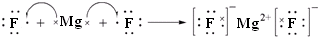 .
.(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(5)比较②③④⑦形成的简单离子半径的大小Cl->F->Na+>Mg2+.
(6)某元素R的气态氢化物为HxR,且R在该氢化物中的质量分数为94%,8.5g的HxR气体在标准状态下的体积是5.6L.则HxR的相对分子量为34;HxR的化学式为H2S.
分析 由元素在周期表中的位置可知,①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为Cl、⑧为Ar、⑨为K、⑩为Br.
(1)稀有气体Ar最不活泼,原子核外有18个电子,有3个电子层,各层电子数为2、8、8;
(2)F元素电负性最大,电子能力最强;地壳中含量最多的金属元素是Al;
(3)②与④形成化合物是MgF2,属于离子化合物,用Mg原子、F原子电子式表示MgF2的形成;
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是高氯酸;K的金属性最强,其最高价氧化物对应水化物的碱性最强;氢氧化铝是两性氢氧化物;
(5)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大;
(6)根据n=$\frac{V}{{V}_{m}}$计算HxR的物质的量,再根据M=$\frac{m}{n}$计算HxR的相对分子质量,结合氢化物中R的质量分数计算R的相对原子质量,可以确定R元素,进而确定分子式.
解答 解:由元素在周期表中的位置可知,①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为Cl、⑧为Ar、⑨为K、⑩为Br.
(1)稀有气体Ar最不活泼,原子核外有18个电子,有3个电子层,各层电子数为2、8、8,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)F元素电负性最大,电子能力最强;地壳中含量最多的金属元素是Al,故答案为:F;Al;
(3)②与④形成化合物是MgF2,属于离子化合物,用Mg原子、F原子电子式表示MgF2的形成过程为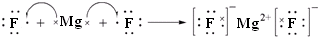 ,
,
故答案为: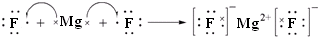 ;
;
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4;K的金属性最强,KOH碱性最强;氢氧化铝是两性氢氧化物,
故答案为:HClO4;KOH;Al(OH)3;
(5)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:Cl->F->Na+>Mg2+,故答案为:Cl->F->Na+>Mg2+;
(6)8.5g的HxR气体在标准状态下的体积是5.6L,其物质的量为$\frac{5.6}{22.4L/mol}$=0.25mol,则HxR的相对分子量为$\frac{8.5}{0.25}$=34,R在该氢化物中的质量分数为94%,则Mr(R)=34×94%=32,故R为S元素,则x=2,故HxR的化学式为H2S,
故答案为:34;H2S.
点评 本题考查元素周期表与元素周期律综合应用,难度不大,注意整体把握元素周期表结构,熟练掌握基础知识.

| A. | 甲多 | B. | 乙多 | C. | 一样多 | D. | 不能确定 |
| A. | $\frac{84{w}_{2}-{w}_{1}}{31{w}_{1}}$ | B. | $\frac{84({w}_{1}-{w}_{2})}{31{w}_{1}}$ | ||
| C. | $\frac{73{w}_{1}-42{w}_{2}}{31{w}_{1}}$ | D. | $\frac{84{w}_{2}-53{w}_{1}}{31{w}_{1}}$ |
| A. | 食盐、稀醋酸和蔗糖都是电解质 | |
| B. | 甲烷和乙烯均可使酸性KMnO4溶液褪色 | |
| C. | 纤维素、淀粉和蛋白质都是高分子化合物 | |
| D. | 乙酸乙酯和植物油均可水解生成乙醇 |
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
 .
.(2)③⑤⑦元素原子形成简单离子的离子半径由大到小的顺序是Cl->F->Al3+(填离子符号).
(3)某元素二价阳离子的核外有10个电子,该元素是镁(填元素名称).
(4)④的单质与水反应的化学方程式是
 (并标出电子转移的方向与数目).
(并标出电子转移的方向与数目).(5)⑦元素的单质常温下的颜色是黄绿色,用电子式表示⑦元素的氢化物形成过程为
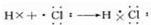 .
.(6)已知某些不同族元素的性质也有一定的相似性,如元素①与⑤元素的氢氧化物有相似的性质,写出元素①的氢氧化物与NaOH溶液反应的化学方程式Be(OH)2+2NaOH=Na2BeO2+2H2O.
| A. | 对溶液所在体系加热,溶液蓝色加深 | |
| B. | 对溶液所在体系用冰水降温,上述反应的平衡常数减小 | |
| C. | 室温下,加水稀释至一定范围,溶液为蓝色 | |
| D. | 室温下,加水稀释至一定范围,溶液为粉红色 |
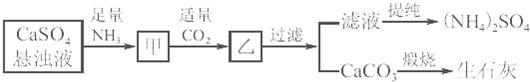
 ,高温下灼烧该化合物火焰呈黄色.
,高温下灼烧该化合物火焰呈黄色. (1)利用原电池原理做如下实验:将一块白铁(镀锌)和一块马口铁(镀锡)上用小刀各划一道刻痕,露出里面的铁,向刻痕上各滴一滴NaCl溶液后,再各滴一滴K3[Fe(CN)6]溶液,放置在空气中,约10分钟观察到有一刻痕变蓝色.回答下列问题:
(1)利用原电池原理做如下实验:将一块白铁(镀锌)和一块马口铁(镀锡)上用小刀各划一道刻痕,露出里面的铁,向刻痕上各滴一滴NaCl溶液后,再各滴一滴K3[Fe(CN)6]溶液,放置在空气中,约10分钟观察到有一刻痕变蓝色.回答下列问题: