题目内容
1.工业上向氨化的CaSO4悬浊液中通入适量CO2,可制取(NH4)2SO4,其流程如图K26-3所示,已知CaSO4的Ksp=2.4×10-4,请回答有关问题: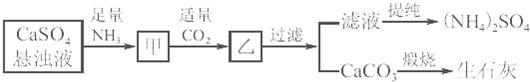
(1)向甲中通入过量CO2否(填“是”或“否”)有利于CaCO3和(NH4)2SO4的生成,原因是CO32-转化为HCO3-,CO32-浓度减小,不利于CaSO4转化为CaCO3.
(2)直接蒸干滤液得到的(NH4)2SO4主要含有的杂质是(NH4)2CO3(填含量最多的一种).
(3)生成1mol (NH4)2SO4消耗的氨气b
a.等于2mol b.大于2mol c.无法确定
(4)写出上述流程中可以循环利用的一种物质CO2.
分析 中性条件下CO2的溶解度很小,但是氨气易溶于水,得到的氨水易和二氧化碳反应,所以CaSO4悬浊液先通入足量的氨气,然后通入适量的二氧化碳,发生反应CO2+2NH3•H2O═(NH4)2CO3,产生高浓度的CO32-,从而发生反应CaSO4+CO32-═CaCO3↓+SO42-,过滤滤液为硫酸铵,滤渣为CaCO3,煅烧碳酸钙,碳酸钙高温煅烧生成氧化钙和二氧化碳,反应的化学方程式为CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,收集其产物CO2,CO2可被循环使用.
(1)若通入过量CO2,CO2与CO32-反应转化为HCO3-,从而使CO32-浓度减小,不利于反应CaSO4+CO32-═CaCO3↓+SO42-,减小CaSO4转化为CaCO3,所以通入过量的CO2不利于CaCO3和(NH4)2SO4的生成;
(2)根据溶液中存在的离子分析,溶液中存在CO32-、SO42-、NH4+,直接蒸干滤液得到的(NH4)2SO4主要含有碳酸盐杂质;
(3)根据原子N守恒知,生成1mol(NH4)2SO4至少消耗2molNH3,阴含有(NH4)2CO3,所以氨气量大于2mol;
(4)煅烧CaCO3时可收集其产物CO2,循环使用.
解答 解:硫酸钙悬浊液通入足量的氨气,使溶液成碱性,再通适量的二氧化碳,与溶液中的氨水、硫酸钙悬浊液反应生成碳酸钙沉淀和硫酸铵溶液,经过过滤分离得到碳酸钙沉淀再煅烧生成生石灰,而滤液硫酸铵经过蒸发浓缩、冷却结晶,过滤、洗涤、干燥得到硫酸铵晶体.
(1)向甲中通入适量CO2,其目的是发生反应CO2+2NH3•H2O═(NH4)2CO3,产生高浓度的CO32-,从而发生反应CaSO4+CO32-═CaCO3↓+SO42-,若通入过量CO2,CO32-转化为HCO3-,不利于沉淀的转化,
故答案为:否;CO32-转化为HCO3-,CO32-浓度减小,不利于CaSO4转化为CaCO3;
(2)已知溶液中存在CO32-、SO42-、NH4+,所以直接蒸干滤液得到的(NH4)2SO4主要含有的杂质是(NH4)2CO3,
故答案为:(NH4)2CO3;
(3)溶液中除含有(NH4)2SO4外,还含有(NH4)2CO3,根据守恒,可知生成1 mol(NH4)2SO4消耗的氨气大于2 mol,
故答案为:b;
(4)滤渣为CaCO3,煅烧碳酸钙,碳酸钙高温煅烧生成氧化钙和二氧化碳,反应的化学方程式为CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,收集其产物CO2,CO2可被循环使用
在煅烧CaCO3时可收集其产物CO2,所以CO2可被循环使用,
故答案为:CO2.
点评 本题考查了工业生成硫酸铵方法,解答本题时要充分理解图中提供的信息,理解流程、理顺物质的相互转化和注意制备的原理是解答关键,本题难度中等.

| A. | 过氧化钙的化学式是CaO2 | |
| B. | 1 mol过氧化钙或过氧化钠跟足量的水反应都生成1mol氧气 | |
| C. | O22-离子的电子式为 | |
| D. | 过氧化钙或过氧化钠都是强氧化剂 |
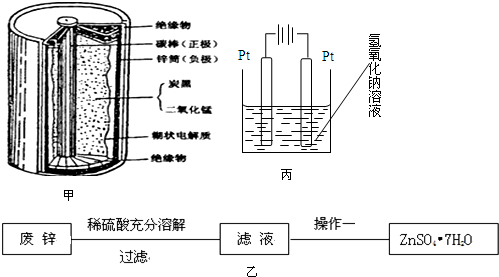
 溴苯,无色油状液体,具有苯的气味.不溶于水,能溶于有机溶剂.实验室制取溴苯时先将铁粉和苯加入反应器,在搅拌下慢慢加入溴苯,置于70-80℃水浴中反应1h,所得粗品用水及5%氢氧化钠溶液洗涤,静置分层,蒸馏;干燥;过滤,最后经常压分馏,取156-157℃馏分而得成品.制取装置如图所示,请依据下列信息回答问题.
溴苯,无色油状液体,具有苯的气味.不溶于水,能溶于有机溶剂.实验室制取溴苯时先将铁粉和苯加入反应器,在搅拌下慢慢加入溴苯,置于70-80℃水浴中反应1h,所得粗品用水及5%氢氧化钠溶液洗涤,静置分层,蒸馏;干燥;过滤,最后经常压分馏,取156-157℃馏分而得成品.制取装置如图所示,请依据下列信息回答问题.| 物质 | 溴 | 苯 | 溴苯 |
| 沸点 | 58.5℃ | 80.1℃ | 156.2℃ |
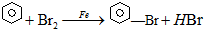 .
.(2)仪器a的名称为三颈烧瓶,仪器c的作用是冷凝回流、导气.
(3)反应置于70-80℃水浴中而非直接加热的目的是使反应受热均匀,尽可能减少反应的挥发,防止生成的溴苯挥发.
(4)水洗后用5%氢氧化钠溶液洗涤的目的Br2+2OH-=Br-+BrO-+H2O(用离子方程式表示).
| A. | 原气体中一定含有NH3、CO2、NO | B. | 原气体中一定不含有HCl、H2、NO2 | ||
| C. | 原气体中可能含有HCl、H2 | D. | 原气体中CO2和NO物质的量比为3:2 |
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 .
.(2)得电子能力最强的是F 地壳中含量最多的金属元素是Al.
(3)用电子式表示②与④形成化合物的过程
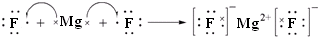 .
.(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(5)比较②③④⑦形成的简单离子半径的大小Cl->F->Na+>Mg2+.
(6)某元素R的气态氢化物为HxR,且R在该氢化物中的质量分数为94%,8.5g的HxR气体在标准状态下的体积是5.6L.则HxR的相对分子量为34;HxR的化学式为H2S.