题目内容
5.下列说法正确的是( )| A. | 食盐、稀醋酸和蔗糖都是电解质 | |
| B. | 甲烷和乙烯均可使酸性KMnO4溶液褪色 | |
| C. | 纤维素、淀粉和蛋白质都是高分子化合物 | |
| D. | 乙酸乙酯和植物油均可水解生成乙醇 |
分析 A、电解质是在水溶液或是熔融态下能导电的化合物;
B、根据甲烷和乙烯的化学性质来回答;
C、高分子化合物是相对分子质量高达几万上百万的有机物;
D、植物油的主要成分是不饱和脂肪酸的甘油酯.
解答 解:A、蔗糖是非电解质,食盐、醋酸是电解质,故A错误;
B、甲烷不可使酸性KMnO4溶液褪色,乙烯可使酸性KMnO4溶液褪色,故B错误;
C、纤维素、淀粉和蛋白质都是高分子化合物,故C正确;
D、乙酸乙酯可水解生成乙醇和乙酸,但是植物油可水解生成不饱和脂肪酸和甘油,故D错误.
故选C.
点评 本题重在考查学生有机物质的性质、常见的概念等方面知识,注意知识的梳理和归纳是解题的关键,难度不大.

练习册系列答案
相关题目
4.将a%的某物质的水溶液加热蒸发掉m g水(溶质不挥发、且蒸发过程无溶质析出),所得溶液体积为VL,溶质的质量分数为蒸发前的2倍,设溶质的相对分子质量为M,则蒸发后所得溶液的物质的量浓度为( )
| A. | $\frac{ma}{50VM}$mol•L-1 | B. | $\frac{ma}{100VM}$ mol•L-1 | C. | $\frac{ma}{2VM}$mol•L-1 | D. | $\frac{10ma}{VM}$mol•L-1 |
13.有一无色混合气体可能是由HCl、NO、NO2、CO2、NH3、H2中的一种或几种混合而成,将此气体通过盛有浓H2SO4时的洗气瓶时,气体体积减小.继续通过装有过氧化钠的干燥管,发现从出气口出来的气体显红棕色,再将该气体全部通入盛满水倒立于水槽中的试管内,发现最后试管里仍为一满试管液体,下列说法不正确的是( )
| A. | 原气体中一定含有NH3、CO2、NO | B. | 原气体中一定不含有HCl、H2、NO2 | ||
| C. | 原气体中可能含有HCl、H2 | D. | 原气体中CO2和NO物质的量比为3:2 |
20.下表为元素周期表的一部分,请用化学用语回答下列有关问题:
(1)常温下呈液态的单质是Br2;元素的气态氢化物和它的最高价氧化物对应的水化物能发生化合反应的元素是N;写出元素⑥对应的离子的电子式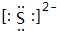 ;①单质的电子式
;①单质的电子式 ;写出⑧的原子结构示意图
;写出⑧的原子结构示意图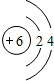 .
.
(2)表中最活泼的金属是K,非金属性最强的元素是F,最高价氧化物对应的水化物酸性最强的酸是HClO4,能形成两性氢氧化物的元素是Al.
(3)由③⑤两元素所形成的原子个数比为1:1的化合物中存在的化学键的种类有离子键、共价键;写出它与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.
(4)④⑥⑦⑨元素对应的离子半径从大到小的顺序S2->Cl->K+>Al3+.
(5)元素⑥和⑦对应的单质的氧化性较强的是Cl2,能证明这一结论的一个实验事实Cl2+H2S=S↓+2HCl.
| 元素 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 二 | ⑧ | ① | ⑤ | ② | |||
| 三 | ③ | ④ | ⑥ | ⑦ | |||
| 四 | ⑨ | ⑩ |
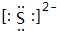 ;①单质的电子式
;①单质的电子式 ;写出⑧的原子结构示意图
;写出⑧的原子结构示意图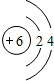 .
.(2)表中最活泼的金属是K,非金属性最强的元素是F,最高价氧化物对应的水化物酸性最强的酸是HClO4,能形成两性氢氧化物的元素是Al.
(3)由③⑤两元素所形成的原子个数比为1:1的化合物中存在的化学键的种类有离子键、共价键;写出它与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.
(4)④⑥⑦⑨元素对应的离子半径从大到小的顺序S2->Cl->K+>Al3+.
(5)元素⑥和⑦对应的单质的氧化性较强的是Cl2,能证明这一结论的一个实验事实Cl2+H2S=S↓+2HCl.
10.下图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
(1)在这些元素中,化学性质最不活泼元素的原子结构示意图为 .
.
(2)得电子能力最强的是F 地壳中含量最多的金属元素是Al.
(3)用电子式表示②与④形成化合物的过程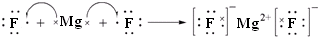 .
.
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(5)比较②③④⑦形成的简单离子半径的大小Cl->F->Na+>Mg2+.
(6)某元素R的气态氢化物为HxR,且R在该氢化物中的质量分数为94%,8.5g的HxR气体在标准状态下的体积是5.6L.则HxR的相对分子量为34;HxR的化学式为H2S.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 .
.(2)得电子能力最强的是F 地壳中含量最多的金属元素是Al.
(3)用电子式表示②与④形成化合物的过程
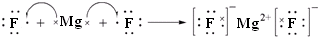 .
.(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(5)比较②③④⑦形成的简单离子半径的大小Cl->F->Na+>Mg2+.
(6)某元素R的气态氢化物为HxR,且R在该氢化物中的质量分数为94%,8.5g的HxR气体在标准状态下的体积是5.6L.则HxR的相对分子量为34;HxR的化学式为H2S.
17.下列分子中所有原子不可能同时存在于同一平面上的是( )
| A. | CH2=CH-CH=CH2 | B. | 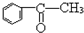 | C. | ClCH=CHCHO | D. | CH≡C-COOH |