题目内容
13.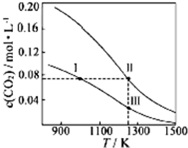 在体积均为1.0L的量恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的量恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 反应CO2(g)+C(s)?2CO(g)的△S>0、△H<0 | |
| B. | 体系的总压强P总:P总(状态Ⅱ)>2P总(状态Ⅰ) | |
| C. | 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
分析 A.由气体的化学计量数增大可知△S,由图中温度高平衡时c(CO2)小可知△H;
B.分别加入0.1molCO2和0.2molCO2,曲线I为加入0.1molCO2,曲线II为加入0.2molCO2,加压CO2(g)+C(s)?2CO(g)平衡逆向移动;
C.状态II、状态Ⅲ的温度相同,状态II看作先加入0.1molCO2,与状态Ⅲ平衡时CO的浓度相同,再加入0.1molCO2,若平衡不移动,Ⅱ状态CO的浓度等于2倍Ⅲ,但再充入CO2,相当增大压强,平衡左移动,消耗CO;
D.状态I、状态Ⅲ的温度不同,温度高反应速率快.
解答 解:A.由气体的化学计量数增大可知△S>0,由图中温度高平衡时c(CO2)小,则升高温度平衡正向移动,可知△H>0,故A错误;
B.分别加入0.1molCO2和0.2molCO2,曲线I为加入0.1molCO2,曲线II为加入0.2molCO2,若平衡不移动,体系的总压强为P总(状态Ⅱ)=2P总(状态Ⅰ),但加压CO2(g)+C(s)?2CO(g)平衡逆向移动,为使c(CO2)相同,则加热使平衡正向移动,则体系的总压强为P总(状态Ⅱ)>2P总(状态Ⅰ),故B正确;
C.状态II、状态Ⅲ的温度相同,状态II看作先加入0.1molCO2,与状态Ⅲ平衡时CO的浓度相同,再加入0.1molCO2,若平衡不移动,Ⅱ状态CO的浓度等于2倍Ⅲ,但再充入CO2,相当增大压强,平衡左移,消耗CO,则c(CO,状态Ⅱ)<2c(CO,状态Ⅲ),故C正确;
D.状态I、状态Ⅲ的温度不同,温度高反应速率快,则逆反应速率为V逆(状态Ⅰ)<V逆(状态Ⅲ),故D错误;
故选BC.
点评 本题考查化学平衡及平衡的建立,为高频考点,本题为2015年江苏高考题,把握平衡移动的影响因素、图象分析为解答的关键,选项BC为解答的难点,题目难度中等.

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案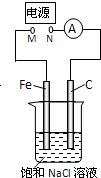
| A. | 去掉电源,将M、N用导线直接相连,则Fe棒上产生气泡 | |
| B. | M接电源负极,N接电源正极,Fe棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| C. | M接电源正极,N接电源负极,将石墨棒换成Cu棒,电解质溶液换成CuSO4溶液,则可实现在铁棒上镀铜 | |
| D. | 去掉电源,将M、N用导线直接相连,烧杯中的溶液换成经酸化的3% NaCl溶液,向Fe电极区滴入2滴K3[Fe(CN)6]溶液,反应一段时间后,烧杯中产生蓝色沉淀 |
| A. | 苯与溴水混合可发生加成反应 | |
| B. | 蛋白质和油脂都属于高分子化合物,一定条件下都能水解 | |
| C. | 煤的干馏可以得到苯、甲苯和二甲苯 | |
| D. |  命名为2-甲基-3-戊烯 命名为2-甲基-3-戊烯 |
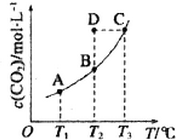 在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是 ( )
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是 ( )| A. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)为吸热反应 | |
| B. | 在T2时,若反应处于状态D,则一定有υ正>υ逆 | |
| C. | 平衡状态A 与C 相-比,平衡状态A 的c(CO)大 | |
| D. | 若T1、T2 时的平衡常数分别为K1、K2则K1>K2 |
| A. | Y2X和Y2X2中化学键类型相同,阴、阳离子的个数比相同 | |
| B. | 气态氢化物的热稳定性:M>N | |
| C. | M与X的化合物对应的水化物一定是强酸 | |
| D. | 离子半径r:r(X2-)>(r+) |
| A. | 含大量 H+的溶液中:CrO42-、Cl-、N03-、Na+ | |
| B. | 含大量 A102-的溶液中:Na+、K+、NO3-、HCO3- | |
| C. | 含大量 Al3+的溶液中:K+、Na+、NO3-、Cl0- | |
| D. | 含大量 CH3COO- 的溶液中:NH4+、Cl-、F-、K+ |
| A. | H2,N2,SO2 | B. | H2,N2,O2 | C. | HCl,NO2,NH3 | D. | O2,NO2,NO |