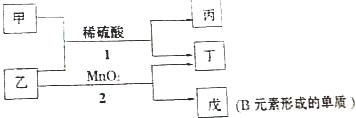
题目内容
1. “凯氏定氮法”测得奶粉中蛋白质含量是由丹麦人约翰•凯达尔发现的.其原理是用强酸处理蛋白质样品,让样品中的氮元素释放出来,通过测得氮的含量,再乘以系数6.38,即为蛋白质含量.凯氏定氮法步骤如下:
“凯氏定氮法”测得奶粉中蛋白质含量是由丹麦人约翰•凯达尔发现的.其原理是用强酸处理蛋白质样品,让样品中的氮元素释放出来,通过测得氮的含量,再乘以系数6.38,即为蛋白质含量.凯氏定氮法步骤如下:①样品处理:准确称取一定质量的奶粉试样置于烧瓶中,加入稀硫酸及相应的催化剂,一定条件下充分反应,所的产物用于水溶解并冷却后全部转移至容量瓶中定容.
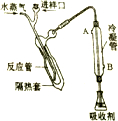
②碱化蒸馏:量取一定容量瓶中溶液转移至如图所示的反应管中,再加入足量NaOH溶液,塞好进样口橡皮塞.通入高温水蒸气,用吸收剂吸收产生的氨气.③滴定:向吸收氨气后的溶液中滴加2滴指示剂,用标准HCl滴定至终点.根据以上知识回答下列问题:
(1)样品处理的目的是将奶粉中氮元素全部转变为NH4+;
(2)碱化蒸馏时反应的离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,冷凝管中冷却水的进水口为B(填“A”或“B”),如何通过简单的实验确定生成的氨气全部被水蒸气蒸出并进入锥形瓶内取最后一滴冷凝流出液,用红色石蕊试纸(或pH试纸)检验不变蓝(显中性).
(3)凯氏定氮法测定奶粉中蛋白质含量灵敏度高,操作简单,缺点是无法确定氮元素是否一定来自于蛋白质.
(4)当奶粉含下列杂质或出现下列错误的实验操作时,会使所测奶粉中蛋白质含量值“增加”的是AC.
A、含三聚氰胺(
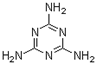 )
) B.样品入口未用蒸馏水冲洗
C.第①步定容时俯视刻度线
D.滴定开始时仰视读数,滴定终点时俯视读数.
分析 凯氏定氮法测定奶粉中蛋白质含量原理为:通过样品处理把氮元素转化为NH4+,加入氢氧化钠转化为氨气,用吸收剂吸收,用盐酸滴定,通过消耗盐酸的量来计算氮元素的含量和蛋白质的含量.
(1)从测量步骤可知样品处理目的是把蛋白质中氮元素转化为NH4+;
(2)铵根离子与氢氧根离子反应生成氨气;冷凝水与蒸汽的流向相反时冷却效果好;根据氨气的性质分析;
(3)样品中释放出来的N元素全部归为蛋白质中的N元素,而样品中释放出来的N元素也可能不是从蛋白质中来的;
(4)A.三聚氰胺(  )含氮量高;
)含氮量高;
B.样品入口未用蒸馏水冲洗,会损失氮元素;
C.第①步定容时俯视刻度线,读数偏小;
D.滴定开始时仰视读数,滴定终点时俯视读数,盐酸读数偏小.
解答 解:(1)蛋白质中的氮元素不容易测定,从测量步骤可知样品处理目的是把蛋白质中氮元素转化为NH4+;
故答案为:将奶粉中氮元素全部转变为NH4+;
(2)铵根离子与氢氧根离子反应生成氨气,则碱化蒸馏时反应的离子方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;冷凝水与蒸汽的流向相反时冷却效果好,所以冷凝水从B口进入,从A口流出;根据氨气的性质分析;氨气的水溶液显碱性,取最后一滴冷凝流出液,用红色石蕊试纸(或pH试纸)检验不变蓝(显中性),则证明氨全部被水蒸出并进入锥形瓶;
故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;B;取最后一滴冷凝流出液,用红色石蕊试纸(或pH试纸)检验不变蓝(显中性);
(3)测定原理为:把蛋白质样品用中的氮元素释放出来,通过测定氮元素的质量从而换算出蛋白质的含量,此方法的局限性很明显,它把样品中释放出来的N元素全部归为蛋白质中的N元素,若样品中含有其他含氮化合物,则无法准确测定蛋白质的含量,
故答案为:无法确定氮元素是否一定来自于蛋白质;
(4)A.三聚氰胺(  )含氮量高,会使计算结果中蛋白质含量值“增加”,故A符合;
)含氮量高,会使计算结果中蛋白质含量值“增加”,故A符合;
B.样品入口未用蒸馏水冲洗,损失了氮元素,会使计算结果中蛋白质含量值偏低,故B不符合;
C.第①步定容时俯视刻度线,读数偏小,则溶液体积偏小,根据c=$\frac{n}{V}$,会使计算结果中蛋白质含量值“增加”,故C符合;
D.滴定开始时仰视读数,滴定终点时俯视读数,盐酸读数偏小,会使计算结果中蛋白质含量值偏低,故D不符合;
故答案为:AC.
点评 本题考查了蛋白质中含氮量测定方法,题目难度中等,试题涉及了元素化合物的性质、实验原理、物质检验等,侧重考查学生对实验方案理解及对元素化合物的知识的应用能力.

| A. | 全部 | B. | ①②③⑤ | C. | ①②③ | D. | ①②③④ |
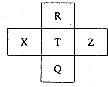 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,R元素原子最外层电子数等于其电子层数的3倍,下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,R元素原子最外层电子数等于其电子层数的3倍,下列判断正确的是( )| A. | X元素的最高价氧化物对应的水化物酸性强于T元素 | |
| B. | 原子半径:R<T<Z | |
| C. | Z的单质可从T的气态氢化物中置换出T的单质 | |
| D. | R、T、Q最高正价相同 |
| A. | CO2和CO浓度比 | B. | 混合气体的密度 | C. | 转化率 | D. | CO 的体积分数 |
| A. | 按系统命名法,有机物 的名称是2,2,4,5-四甲基-3,3-二乙基己烷 的名称是2,2,4,5-四甲基-3,3-二乙基己烷 | |
| B. | 苯、甲苯、二甲苯互为同系物,均能使酸性高锰酸钾溶液褪色 | |
| C. | 等质量的苯、乙炔、乙烯和甲烷分别在氧气中充分燃烧,所消耗的氧气的量依次增加 | |
| D. | 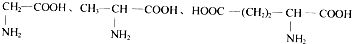 三种氨基酸之间脱水,最多可生成6种二肽 三种氨基酸之间脱水,最多可生成6种二肽 |
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验1、2、3、4按下列表格药品用量实验,并都加水稀释至10mL,假设加水后两者开始反应(下面实验同),均在室温下观察溶液颜色褪去时间,并记录如下:
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | ||
| 0.6 mol/L H2C2O4溶液 | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 1.0 | 2.0 | 6.4 |
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度反应速率增大.
(2)利用实验1中数据计算,用KMnO4的浓度变化表示从反应开始至颜色褪色这段时间该反应的反应速率为:
υ(KMnO4)=1.5×10-2mol/(L•min).
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示.该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.

①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | ||
| 0.6 mol/L H2C2O4溶液 | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 4 | 3.0 | 3.0 | 2.0 | t | |
| A. | I2升华 | B. | NaCl颗粒被粉碎 | ||
| C. | H2SO4溶于水得硫酸溶液 | D. | NaOH受热熔化 |
| A. | 有很高的熔点和沸点 | B. | 易汽化,可用作制冷材料 | ||
| C. | 含有极性共价键 | D. | 硬度大,可用作耐磨材料 |