题目内容
3.反应2C+CO2(g)?2CO(g)达到化学平衡后,保持其他条件不变,移走少量CO,达到新的平衡后,下列选项中,增大的是( )| A. | CO2和CO浓度比 | B. | 混合气体的密度 | C. | 转化率 | D. | CO 的体积分数 |
分析 高温下,在容积固定的密闭容器中,用足量焦炭与一定量二氧化碳发生可逆的吸热反应生成了CO,反应的化学方程式为:C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO,反应达到平衡状态后移走少量CO,平衡正向进行,结合反应特征和平衡移动原理分析判断选项.
解答 解:C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO,反应达到平衡状态后移走少量CO,平衡正向进行,
A、平衡正向进行,二氧化碳减小,一氧化碳增加,CO2和CO浓度比减小,故A不符合;
B、移走少量CO,平衡正向进行,气体质量减小,体积不变,混合气体的密度减小,故B不符合;
C、移走少量CO,平衡正向进行反应物转化率增大,故C符合;
D、移走少量CO,达到新的平衡时二氧化碳减小,一氧化碳增多,所以CO的体积分数增大,故D符合;
故选:CD.
点评 本题考查了化学平衡影响因素分析判断,主要是改变物质浓度对反应平衡的理解应用,注意一氧化碳体积分数的变化分析,掌握基础是解题关键,题目难度中等.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
13.某元素构成的双原子单质分子有3种,其中相对分子量分别为158、160、162..在天然的单质中,这三种单质的物质的量之比为1;1:1,由此推断以下结论中,正确的是( )
| A. | 此元素有三种同位素 | |
| B. | 其中质量数为79的同位素原子占原子总数 $\frac{1}{2}$ | |
| C. | 其中一种同位素质量数为80 | |
| D. | 此元素单质的平均相对分子质量为160 |
18.下列关于有机化合物的说法中,正确的是( )
| A. | 乙醇、乙酸都可以与钠反应生成氢气 | |
| B. | 油脂、淀粉、纤维素都属于天然高分子化合物 | |
| C. | 甲苯和乙烯都可与溴水发生化学反应造成溴水褪色 | |
| D. | 蛋白质溶液加入CuSO4溶液会析出,这一过程属于蛋白质的盐析 |
8.酸碱中和滴定是最基本的定量分析化学实验,常温下,向50mL0.5mol•L-1HA溶液中逐滴加入强碱MOH溶液,图中所示曲线表示混合溶液的pH变化情况(条件变化忽略不计).下列叙述正确的是( )


| A. | 由图中信息可知HA为强酸,N点表示酸碱恰好中和 | |
| B. | 常温下,一定浓度的MA稀溶液的pH<7 | |
| C. | K点所对应的溶液中离子浓度的大小关系:c(M+)>c(OH-)>c(A-)>c(H+) | |
| D. | K点对应的溶液中,溶液的pH>13.c(HA)+c(A-)=0.25mol•L-1 |
5.下列应用中,主要利用物质氧化性的是( )
| A. | 用烟道气中和碱性废水 | B. | 重铬酸钾用于酒驾检査 | ||
| C. | 用苯酚制造酚醛树脂 | D. | 金属加工前用硫酸酸洗 |
6. 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
(1)已知2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
H2O(g)=H2O(1)△H=-44.0kJ/mol
甲醇不完全燃烧生成气态水的热化学方程式为2CH3OH(l)+O2(g)=2CO(g)+4H2O(l)△H=-533.6kJ•mol-1
若不完全燃烧20g甲醇生成液态水,此时放出的热量为333.5kJ
(2)用CO2来生产燃料甲醇的反应原理:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
计算上述反应的焓变△H=(2d+6b-3a-c-3e)kJ/mol(用相应字母表示),若只加压,则平衡常数K不变(选填“增大”,“减小”或“不变”);
(3)高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g)
若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如表:
下列关系正确的是AD
A.c1=c2 B.2Q1=Q3 C.2a1=a3 D.a1+a2=1
E.该反应若生成1molCH2OH,则放出(Q1+Q3)kJ热量
(4)若在一体积可变的密闭容器中充入1molCO、2molH2和1molCH2OH,达到平衡时测得混合气体的密度是同温同压下起始密度的1.6倍,则达平衡前v(正)>v(逆)(填“>”、“<”或“=”);
(5)甲醇一空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间后纯Cu质量增加3.2g(粗铜中杂质不参与电极反应).
①请写出燃料电池中的负极反应式:CH3OH-6e-+8OH-=CO32-+6H2O
②燃料电池正极消耗空气的体积是2.8L(标准状态,空气中O2体积分数以20%计算).
 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.(1)已知2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
H2O(g)=H2O(1)△H=-44.0kJ/mol
甲醇不完全燃烧生成气态水的热化学方程式为2CH3OH(l)+O2(g)=2CO(g)+4H2O(l)△H=-533.6kJ•mol-1
若不完全燃烧20g甲醇生成液态水,此时放出的热量为333.5kJ
(2)用CO2来生产燃料甲醇的反应原理:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
| 化学键 | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | a | b | c | d | e |
(3)高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g)
若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如表:
| 容器 | 反应物投入的量 | 反应物的转化率 | CH2OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1molCO和2molH2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1molCH3OH | a2 | c2 | 放出Q2kJ热量 |
| 丙 | 2molCO和4molH2 | a3 | c3 | 放出Q3kJ热量 |
A.c1=c2 B.2Q1=Q3 C.2a1=a3 D.a1+a2=1
E.该反应若生成1molCH2OH,则放出(Q1+Q3)kJ热量
(4)若在一体积可变的密闭容器中充入1molCO、2molH2和1molCH2OH,达到平衡时测得混合气体的密度是同温同压下起始密度的1.6倍,则达平衡前v(正)>v(逆)(填“>”、“<”或“=”);
(5)甲醇一空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间后纯Cu质量增加3.2g(粗铜中杂质不参与电极反应).
①请写出燃料电池中的负极反应式:CH3OH-6e-+8OH-=CO32-+6H2O
②燃料电池正极消耗空气的体积是2.8L(标准状态,空气中O2体积分数以20%计算).
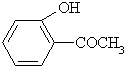 乙:
乙: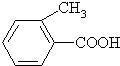 丙:
丙: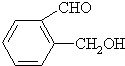
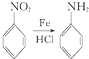
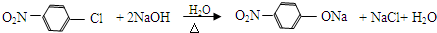
 .
.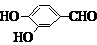 、
、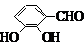 、
、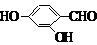 、
、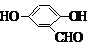 (其中三种)(写出3种).
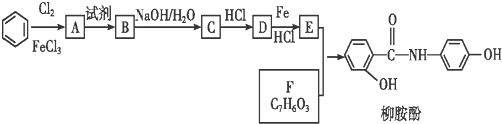
(其中三种)(写出3种).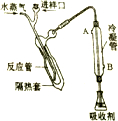 “凯氏定氮法”测得奶粉中蛋白质含量是由丹麦人约翰•凯达尔发现的.其原理是用强酸处理蛋白质样品,让样品中的氮元素释放出来,通过测得氮的含量,再乘以系数6.38,即为蛋白质含量.凯氏定氮法步骤如下:
“凯氏定氮法”测得奶粉中蛋白质含量是由丹麦人约翰•凯达尔发现的.其原理是用强酸处理蛋白质样品,让样品中的氮元素释放出来,通过测得氮的含量,再乘以系数6.38,即为蛋白质含量.凯氏定氮法步骤如下: )
)