题目内容
11.美国《Science》杂志曾经报道:在40GPa高压下,用激光器加热到1800K,人们成功制得了原子晶体干冰.有关原子晶体干冰的推断错误的是( )| A. | 有很高的熔点和沸点 | B. | 易汽化,可用作制冷材料 | ||
| C. | 含有极性共价键 | D. | 硬度大,可用作耐磨材料 |
分析 A.原子晶体具有很高的熔点、沸点;
B.原子晶体沸点很高;
C.不同非金属元素之间形成极性键;
D.原子晶体硬度大,可用作耐磨材料.
解答 解:A.原子晶体具有很高的熔点、沸点,所以原子晶体干冰有很高的熔点、沸点,故A正确;
B.原子晶体干冰有很高的沸点,不易汽化,不可用作致冷剂,故B错误;
C.不同非金属元素之间形成极性键,二氧化碳中存在O=C极性键,故C正确;
D.原子晶体硬度大,所以原子晶体干冰的硬度大,可用作耐磨材料,故D正确;
故选B.
点评 本题以信息为载体,考查原子晶体的性质与结构,注意基础知识的掌握,难度不大.

练习册系列答案
相关题目
2.某学习小组的同学在学习了化学反应速率与化学平衡知识后,对反应:aA(g)+bB(g)?cC(g)+dD(g)△H,反应特点与对应的图象展开了讨论,其中不正确的是( )
| A. | 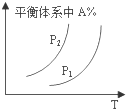 图中,若P1>P2,则该反应在较低温度下有利于自发进行 | |
| B. |  图中,若T2>T1,则△H<0且a+b=c+d | |
| C. | 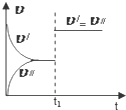 图中(v′表示正反应速率,v″表示逆反应速率),t1时刻改变的条件一定是使用了催化剂 | |
| D. | 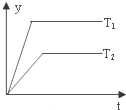 图中,若△H<0,则纵坐标不可能表示的是反应物的转化率 |
19.化学无处不在,下列说法正确的是( )
| A. | 工业上制取玻璃的工艺是应用了物质酸性的差异 | |
| B. | 家庭里可用淀粉检验加碘盐是否含有碘 | |
| C. | 铁是人体必需的微量元素,所以可以适当地吃点铁锈 | |
| D. | 王水是由浓盐酸和浓硝酸两种物质按3:1的体积比混合配制成的 |
6. 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
(1)已知2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
H2O(g)=H2O(1)△H=-44.0kJ/mol
甲醇不完全燃烧生成气态水的热化学方程式为2CH3OH(l)+O2(g)=2CO(g)+4H2O(l)△H=-533.6kJ•mol-1
若不完全燃烧20g甲醇生成液态水,此时放出的热量为333.5kJ
(2)用CO2来生产燃料甲醇的反应原理:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
计算上述反应的焓变△H=(2d+6b-3a-c-3e)kJ/mol(用相应字母表示),若只加压,则平衡常数K不变(选填“增大”,“减小”或“不变”);
(3)高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g)
若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如表:
下列关系正确的是AD
A.c1=c2 B.2Q1=Q3 C.2a1=a3 D.a1+a2=1
E.该反应若生成1molCH2OH,则放出(Q1+Q3)kJ热量
(4)若在一体积可变的密闭容器中充入1molCO、2molH2和1molCH2OH,达到平衡时测得混合气体的密度是同温同压下起始密度的1.6倍,则达平衡前v(正)>v(逆)(填“>”、“<”或“=”);
(5)甲醇一空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间后纯Cu质量增加3.2g(粗铜中杂质不参与电极反应).
①请写出燃料电池中的负极反应式:CH3OH-6e-+8OH-=CO32-+6H2O
②燃料电池正极消耗空气的体积是2.8L(标准状态,空气中O2体积分数以20%计算).
 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.(1)已知2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
H2O(g)=H2O(1)△H=-44.0kJ/mol
甲醇不完全燃烧生成气态水的热化学方程式为2CH3OH(l)+O2(g)=2CO(g)+4H2O(l)△H=-533.6kJ•mol-1
若不完全燃烧20g甲醇生成液态水,此时放出的热量为333.5kJ
(2)用CO2来生产燃料甲醇的反应原理:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
| 化学键 | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | a | b | c | d | e |
(3)高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g)
若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如表:
| 容器 | 反应物投入的量 | 反应物的转化率 | CH2OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1molCO和2molH2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1molCH3OH | a2 | c2 | 放出Q2kJ热量 |
| 丙 | 2molCO和4molH2 | a3 | c3 | 放出Q3kJ热量 |
A.c1=c2 B.2Q1=Q3 C.2a1=a3 D.a1+a2=1
E.该反应若生成1molCH2OH,则放出(Q1+Q3)kJ热量
(4)若在一体积可变的密闭容器中充入1molCO、2molH2和1molCH2OH,达到平衡时测得混合气体的密度是同温同压下起始密度的1.6倍,则达平衡前v(正)>v(逆)(填“>”、“<”或“=”);
(5)甲醇一空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间后纯Cu质量增加3.2g(粗铜中杂质不参与电极反应).
①请写出燃料电池中的负极反应式:CH3OH-6e-+8OH-=CO32-+6H2O
②燃料电池正极消耗空气的体积是2.8L(标准状态,空气中O2体积分数以20%计算).
16.工业上以CaO和HNO3为原料制备Ca(NO3)2•6H2O晶体.为确保制备过程中既不补充水分,也无多余的水分,所用硝酸溶液中溶质的质量分数应为( )
| A. | 53.8% | B. | 58.3% | C. | 60.3% | D. | 70.0% |
3.下列实验目的能实现的是( )
| A. |  实验室制取乙炔 | B. |  实验室制取Fe(OH)2 | ||
| C. |  实验室制取少量氨气 | D. |  实验室制取乙酸丁酯 |
20.某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,设计如图原电池,盐桥中装有饱和溶液.下列说法正确的是( )


| A. | b电极上发生还原反应 | |
| B. | 外电路电子的流向是从a到b | |
| C. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| D. | a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O |
1.下列装置能够组成原电池的是( )
| A. |  | B. | 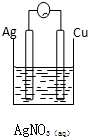 | C. | 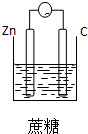 | D. | 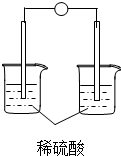 |
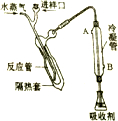 “凯氏定氮法”测得奶粉中蛋白质含量是由丹麦人约翰•凯达尔发现的.其原理是用强酸处理蛋白质样品,让样品中的氮元素释放出来,通过测得氮的含量,再乘以系数6.38,即为蛋白质含量.凯氏定氮法步骤如下:
“凯氏定氮法”测得奶粉中蛋白质含量是由丹麦人约翰•凯达尔发现的.其原理是用强酸处理蛋白质样品,让样品中的氮元素释放出来,通过测得氮的含量,再乘以系数6.38,即为蛋白质含量.凯氏定氮法步骤如下: )
)