题目内容
16.二甲醛是一种重要的化工原料,利用水煤气(CO、H2)合成二甲醛是工业上的常用方法,该方法由以下几步组成: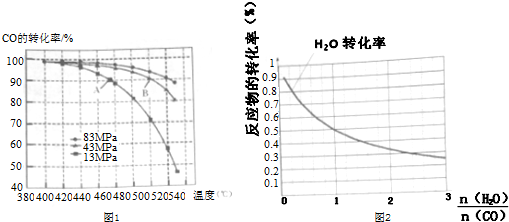
2H2(g)+CO(g)?CH3OH(g)△H=-90.0kJ•mol-1 ①
2CH3OH(g)?CH3OCH3(g)△H=-24.5kJ•mol-1 ②
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.1mol kJ•mol-1 ③
(1)反应①的△S<0(填“>”“<”或“=”),在较低(填“较高”或“较低”)温度下该反应自发进行.
(2)在250℃的恒容密闭容器中,下列事实可以作为反应③已达平衡的是BC(填选项字母).
A.容器内气体密度保持不变
B.CO与CO2的物质的量之比保持不变
C.H2O与CO2的生成速率之比为1:1
D.该反应的平衡常数保持不变
(3)已知一些共价键的键能如下:
| 共价键 | H-H | C-H | C-O | O-H |
| 键能(kJ-mol-3) | 436 | 414 | 326 | 464 |
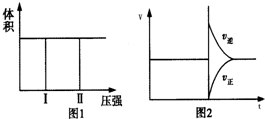
(4)当合成气体中CO与H2的物质的量之比恒定时,温度、压强CO转化率的影响如图1所示.图1中A点的v(逆)<B点的v(正)(填“>”“<”或“=”).说明理由B点对应的温度和压强都比A点高,温度升高,或压强增大,都会加快反应速率.实际工业生产中该合成反应的条件为500℃、4MPa,请回答采用500℃的可能原因500℃时一氧化碳转化率较大,反应速率也较快.若温度过高,一氧化碳转化率降低,若温度过低,反应速率太慢.
(5)一定温度下,密闭容器中发生反应③,水蒸气的转化率与a(H2O)/h(CO)的关系如图2所示,计算该温度下发生反应③的平衡常数K=1.
在图2中作出一氧化碳的转化率n(H2O)/n(CO)的曲线.
分析 (1)反应①是正反应气体体积减小的反应,△H-T△S<0的反应能够自发进行.
(2)可逆反应达到平衡状态时,正逆反应速率相等,各组分浓度保持不变,据此分析;
(3)反应2H2(g)+CO(g)?CH3OH(g)△H=-90.0kJ•mol-1 的 焓变=反应物 键能和-生成物键能和;
(4)B点温度和压强比A点高,温度越高或压强越大反应速率越快;500℃时一氧化碳转化率较大,反应速率也较快.若温度过高,一氧化碳转化率降低,若温度过低,反应速率太慢;
(5)在反应CO(g)+H2O(g)?CO2(g)+H2(g)中,$\frac{n({H}_{2}O)}{n(CO)}$=1时,反应物转化率为0.5,说明平衡时各组分浓度之比等于1:1:1:1,其平衡常数为1;
反应中,反应物物质的量之比为1:1,当$\frac{n({H}_{2}O)}{n(CO)}$=1时,其转化率相等,CO增多时,其本身的转化率降低,水蒸气的转化率增大.
解答 解:(1)反应①是正反应气体体积减小的反应,△S<0,该反应的△H<0,在低温下△H-T△S<0,故答案为:<;较低;
(2)反应CO(g)+H2O(g)?CO2(g)+H2(g)前后气体体积不变,
A.恒容容器中,混合气体的密度始终不变,所以容器内气体密度保持不变不能说明反应达到平衡状态,故A错误;
B.CO与CO2的物质的量之比保持不变,说明反应物和生成物浓度不变,反应达到平衡状态,故B正确;
C.H2O与CO2的生成速率之比为1:1,说明正逆反应速率相等,反应达到平衡状态,故C正确;
D.化学平衡常数只受温度影响,温度不变其不变,所以该反应的平衡常数保持不变不能说明反应达到平衡状态,故D错误;
故答案为:BC;
(3)反应2H2(g)+CO(g)?CH3OH(g)△H=-90.0kJ•mol-1 的 焓变=反应物键能和-生成物键能和,2×436+Q(CO)-3×414-326-464=-90.0,Q(CO)=1070,
故答案为:1070;
(4)B点温度和压强比A点高,温度越高或压强越大反应速率越快;500℃时一氧化碳转化率较大,反应速率也较快.若温度过高,一氧化碳转化率降低,若温度过低,反应速率太慢,
故答案为:<;B点对应的温度和压强都比A点高,温度升高,或压强增大,都会加快反应速率;500℃时一氧化碳转化率较大,反应速率也较快.若温度过高,一氧化碳转化率降低,若温度过低,反应速率太慢;
(5)在反应CO(g)+H2O(g)?CO2(g)+H2(g)中,$\frac{n({H}_{2}O)}{n(CO)}$=1时,反应物转化率为0.5,说明平衡时各组分浓度之比等于1:1:1:1,其平衡常数为1;反应中,反应物物质的量之比为1:1,当$\frac{n({H}_{2}O)}{n(CO)}$=1时,其转化率相等,CO增多时,其本身的转化率降低,水蒸气的转化率增大,即随$\frac{n({H}_{2}O)}{n(CO)}$的增大,CO转化率增大,水蒸气的转化率减小,图象为: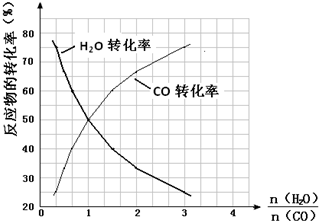 ,
,
故答案为:1; .
.
点评 本题考查了可逆反应自发进行的条件、化学平衡状态的判断、工业生产中反应条件的选择、转化率的相关知识,题目难度较大.

 应用题作业本系列答案
应用题作业本系列答案| A. | υD=0.4mol/(L•s) | B. | υC=0.5mol/(L•s) | C. | υB=0.6mol/(L•s) | D. | υA=0.22mol/(L•s) |
| A. | 若把2molX和1 molY充入该容器时,处于状 态Ⅰ,达到平衡时处于状态Ⅱ(如图1所示),则该反应的正反应是吸热反应 | |
| B. | 若维持该题条件不变,仅从生成物开始配比,要求达到平衡时,Z的物质的量仍为 p mol,则W的起始物质的量n(W)应满足的条件是n(W)>(1-0.5p) mol | |
| C. | 反应达到平衡后,再将2molX和1 molY充入该容器中,则反应速率V与时间t关系图如图2所示 | |
| D. | 若降低原平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的密度未发生改变 |
| A. | R一定是共价化合物 | |
| B. | R一定是离子化合物 | |
| C. | R可能是共价化合物,也可能是离子化合物 | |
| D. | R是HCl |