题目内容
11.用含少量铁的氧化物的氧化铜制取硫酸铜晶体( CuSO4.xH2O).其流程如下:
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解.
(1)溶液A中可能含有Fe2+,确定该溶液中Fe2+存在的试剂是C(填序号)
A.H2O2 B.NaOH C.酸性KMnO4 D.KSCN
(2)欲用(1)中选择的检验试剂测定溶液A中Fe2+的浓度,实验前,首先要配制一定物质的量浓度的检验试剂的溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、250ml容量瓶外,还需胶头滴管,下列滴定方式中,最合理的是b(夹持部分略去)

判断达到滴定终点的方法是滴入最后一滴溶液变为紫红色且半分钟不褪色.
写出滴定反应的离子方程式5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O.
(3)试剂1为稀硫酸,试剂2的作用为将溶液中的Fe2+转化为Fe3+,操作1的名称为过滤.
(4)要得到较纯的产品,试剂3可选用bde.
a.NaOH b.CuO c.FeO d.Cu(OH)2 e.Cu2(0H)2CO3.
分析 用含少量铁的氧化物的氧化铜加试剂1为硫酸,溶解样品得到溶液中生成CuSO4,Fe2(SO4)3,、FeSO4,加试剂2为氧化剂,最好加入绿色氧化剂过氧化氢,把亚铁离子氧化为铁离子,再加入试剂3调节pH,铁离子转化为氢氧化铁沉淀,但需要加入的试剂3不能引入新的杂质,过滤得到的滤液为CuSO4溶液,蒸发浓缩、冷却结晶得到氯化铜晶体;
(1)亚铁离子的检验方法是利用加入的KSCN溶液不变色,再加入氯水,溶液变红色设计检验,但溶液中含有铁离子,所以不能用KSCN检验,可以利用亚铁离子具有还原性,可以和高锰酸钾溶液反应使之褪色;
(2)根据配制一定物质的量浓度的KMnO4溶液所需仪器和高锰酸钾的性质来分析,高锰酸钾溶液具有强氧化性,不能用碱式滴定管,高锰酸钾溶液是紫红色,滴入最后一滴溶液变为紫红色且半分钟不褪色证明反应达到终点,亚铁离子酸性溶液中被高锰酸根离子氧化为铁离子,本身被还原为锰离子;
(3)流程分析用含少量铁的氧化物的氧化铜加试剂1为硫酸,溶解样品得到溶液中生成CuSO4,Fe2(SO4)3,、FeSO4,加试剂2为氧化剂,把亚铁离子氧化为铁离子,再加入试剂3调节pH,铁离子转化为氢氧化铁沉淀,但需要加入的试剂3不能引入新的杂质,过滤得到的滤液为CuSO4溶液;
(4)上述分析可知要得到较纯的产品,试剂3和酸反应但不能引入其他杂质,应是含铜离子的试剂.
解答 解:用含少量铁的氧化物的氧化铜加硫酸溶解生成硫酸铜、硫酸铁、硫酸亚铁,加氧化剂把亚铁离子氧化为铁离子,再调节pH,铁离子转化为氢氧化铁沉淀,过滤得到的滤液为硫酸铜溶液,蒸发浓缩、冷却结晶得到氯化铜晶体;
(1)亚铁离子的检验方法是利用加入的KSCN溶液不变色,再加入氯水,溶液变红色设计检验,但溶液中含有铁离子,所以不能用KSCN检验,可以利用亚铁离子具有还原性,可以和高锰酸钾溶液反应使之褪色,
A.加入 H2O2 可以氧化亚铁离子,但现象不明显,故A不符合;
B.加入NaOH溶液,铁离子、亚铁离子都会生成沉淀,反应现象不明显,不能检验亚铁离子的存在,故B不符合;
C.酸性KMnO4 具有氧化性氧化亚铁离子会褪色,故C符合;
D.KSCN遇到铁离子形成血红色溶液,不能检验亚铁离子的存在,故D不符合;
故答案为:C;
(2)根据配制一定物质的量浓度的KMnO4溶液所需仪器和高锰酸钾的性质来分析,要配制一定物质的量浓度的检验试剂的溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、250ml容量瓶外,还需胶头滴管;高锰酸钾溶液具有强氧化性,不能用碱式滴定管,高锰酸钾溶液是紫红色,滴入最后一滴溶液变为紫红色且半分钟不褪色证明反应达到终点,亚铁离子酸性溶液中被高锰酸根离子氧化为铁离子,本身被还原为锰离子,反应的离子方程式为:5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O;
故答案为:胶头滴管;b;滴入最后一滴溶液变为紫红色且半分钟不褪色;5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O;
(3)流程分析用含少量铁的氧化物的氧化铜加试剂1为硫酸,溶解样品得到溶液中生成CuSO4,Fe2(SO4)3,、FeSO4,加试剂2为氧化剂,最好加入绿色氧化剂过氧化氢,把亚铁离子氧化为铁离子,再加入试剂3调节pH,铁离子转化为氢氧化铁沉淀,但需要加入的试剂3不能引入新的杂质,过滤得到的滤液为CuSO4溶液;
故答案为:稀硫酸,将溶液A中Fe2+转化为Fe3+;过滤;
(4)上述分析可知要得到较纯的产品,试剂3和酸反应但不能引入其他杂质,应是含铜离子的试剂,
a.NaOH和酸反应可以调节溶液PH,但会引入钠离子,故a不符合;
b.CuO和酸反应可以调节溶液PH且不引入杂质,故b符合;
c.FeO和酸反应可以调节溶液PH,但会引入亚铁离子,故c不符合;
d.Cu(OH)2 和酸反应可以调节如PH且不引入杂质离子,故d符合;
e.Cu2(0H)2CO3和酸反应可以调节溶液PH且不引入杂质离子,故e符合;
故答案为:bde.
点评 本题考查了物质分离和提纯的分析判断,主要是物质性质分析,实验过程分析应用,滴定实验的操作方法和仪器的使用注意问题,除杂试剂的选择是解题关键,题目难度中等.

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案| A. | M+N=Q+R | B. | M+2N=2R+Q | C. | 2M+N=2R+Q | D. | 2M+N=R+2Q |
| A. | 平衡向正反应方向移动 | B. | 物质B的转化率降低 | ||
| C. | x+y<z | D. | 物质C的体积分数增大 |
2H2(g)+CO(g)?CH3OH(g)△H=-90.0kJ•mol-1 ①
2CH3OH(g)?CH3OCH3(g)△H=-24.5kJ•mol-1 ②
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.1mol kJ•mol-1 ③
(1)反应①的△S<0(填“>”“<”或“=”),在较低(填“较高”或“较低”)温度下该反应自发进行.
(2)在250℃的恒容密闭容器中,下列事实可以作为反应③已达平衡的是BC(填选项字母).
A.容器内气体密度保持不变
B.CO与CO2的物质的量之比保持不变
C.H2O与CO2的生成速率之比为1:1
D.该反应的平衡常数保持不变
(3)已知一些共价键的键能如下:
| 共价键 | H-H | C-H | C-O | O-H |
| 键能(kJ-mol-3) | 436 | 414 | 326 | 464 |
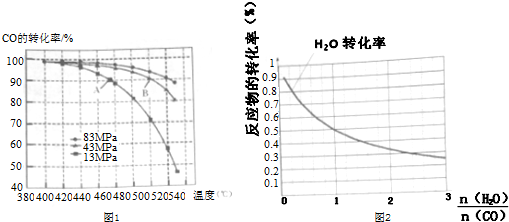
(4)当合成气体中CO与H2的物质的量之比恒定时,温度、压强CO转化率的影响如图1所示.图1中A点的v(逆)<B点的v(正)(填“>”“<”或“=”).说明理由B点对应的温度和压强都比A点高,温度升高,或压强增大,都会加快反应速率.实际工业生产中该合成反应的条件为500℃、4MPa,请回答采用500℃的可能原因500℃时一氧化碳转化率较大,反应速率也较快.若温度过高,一氧化碳转化率降低,若温度过低,反应速率太慢.
(5)一定温度下,密闭容器中发生反应③,水蒸气的转化率与a(H2O)/h(CO)的关系如图2所示,计算该温度下发生反应③的平衡常数K=1.
在图2中作出一氧化碳的转化率n(H2O)/n(CO)的曲线.
| A. | 所有碳原子间只以单键相连的链烃是烷烃 | |
| B. | 所有糖类物质都有甜味 | |
| C. | 糖类、油脂、蛋白质都能水解 | |
| D. | 葡萄糖与蔗糖互为同分异构体 |
| A. | (CH3)2C(Cl)CH2CH3的名称为:2-氯-2-甲基丁烷 | |
| B. | 某烷烃主链含4个碳原子的结构有2种,则与其碳原子个数相同且主链有4个碳原子的单烯烃有4种 | |
| C. | 1mol 与NaOH溶液反应,最多消耗5molNaOH 与NaOH溶液反应,最多消耗5molNaOH | |
| D. | 1molβ-紫罗兰酮(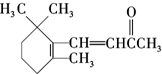 )与1molBr2发生加成反应得到3种不同产物 )与1molBr2发生加成反应得到3种不同产物 |
 如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压胶管的胶头,下列与实验事实不相符的是( )
如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压胶管的胶头,下列与实验事实不相符的是( )| A. | NH3(H2O含石蕊) 蓝色喷泉 | B. | Cl2(饱和食盐水) 无色喷泉 | ||
| C. | HCl (H2O含石蕊) 红色喷泉 | D. | SO2(NaOH溶液) 无色喷泉 |
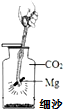 《消防知识手册》指出:活泼金属(如镁)燃烧引发的火灾不能用二氧化碳灭火.小明想:是不是活泼金属能与二氧化碳反应?他向老师要来镁带、一集气瓶的二氧化碳气体和必要的器材,在老师指导下按照如图所示进行实验.请回答下列问题.
《消防知识手册》指出:活泼金属(如镁)燃烧引发的火灾不能用二氧化碳灭火.小明想:是不是活泼金属能与二氧化碳反应?他向老师要来镁带、一集气瓶的二氧化碳气体和必要的器材,在老师指导下按照如图所示进行实验.请回答下列问题.