题目内容
5.铝单质的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图乙所示.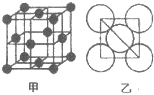
若已知铝原子半径为d,NA表示阿伏伽德罗常数,摩尔质量为M,则该晶体的密度表示为$\frac{\sqrt{2}M}{8{N}_{A}{d}^{3}}$g/cm3.据上图计算,铝原子采取的面心立方堆积的空间利用率为74%.
分析 铝原子半径为d,对角线上三个铝原子相邻,对角线长度=4d,则晶胞棱长=$\sqrt{\frac{(4d)^{2}}{2}}$=2$\sqrt{2}$d,晶胞体积=(2$\sqrt{2}$d)3,该晶胞中Al原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞密度=$\frac{m}{V}$;
每个铝原子体积=$\frac{4}{3}π{d}^{3}$,该晶胞中含有4个Al原子,所以晶胞中所有铝原子体积=4×$\frac{4}{3}π{d}^{3}$,空间利用率=$\frac{所有铝原子体积}{晶胞体积}×100%$.
解答 解:铝原子半径为d,对角线上三个铝原子相邻,对角线长度=4d,则晶胞棱长=$\sqrt{\frac{(4d)^{2}}{2}}$=2$\sqrt{2}$d,晶胞体积=(2$\sqrt{2}$d)3,该晶胞中Al原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞密度=$\frac{m}{V}$=$\frac{\frac{M}{{N}_{A}}×4}{(2\sqrt{2}d)^{3}}$g/cm3=$\frac{\sqrt{2}M}{8{N}_{A}{d}^{3}}$g/cm3;
每个铝原子体积=$\frac{4}{3}π{d}^{3}$,该晶胞中含有4个Al原子,所以晶胞中所有铝原子体积=4×$\frac{4}{3}π{d}^{3}$,空间利用率=$\frac{所有铝原子体积}{晶胞体积}×100%$=$\frac{4×\frac{4}{3}π{d}^{3}}{(2\sqrt{2}d)^{3}}$×100%=74%,
故答案为$\frac{\sqrt{2}M}{8{N}_{A}{d}^{3}}$g/cm3;74%.
点评 本题考查晶胞计算,侧重考查分析计算能力及空间想象能力,明确密度公式中“$\frac{M}{{N}_{A}}×4$”的含义是解本题关键,注意棱上两个原子不相邻,为易错点.

| A. | 在研究物质微观结构的过程中,科学家先后使用了扫描隧道显微镜、光学显微镜、电子显微镜等观测仪器 | |
| B. | “纳米铜”具有非常强的化学活性,在空气中可以燃烧,因为它比铜片更易失去电子 | |
| C. | 室温离子液体是指在室温或接近室温下呈现的完全由阴、阳离子所组成的盐,(C2H5NH3)NO3可能是其中一种 | |
| D. | 肼、氨、甲醇燃料电池的热值远高于燃料普通燃烧的热值 |

2H2(g)+CO(g)?CH3OH(g)△H=-90.0kJ•mol-1 ①
2CH3OH(g)?CH3OCH3(g)△H=-24.5kJ•mol-1 ②
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.1mol kJ•mol-1 ③
(1)反应①的△S<0(填“>”“<”或“=”),在较低(填“较高”或“较低”)温度下该反应自发进行.
(2)在250℃的恒容密闭容器中,下列事实可以作为反应③已达平衡的是BC(填选项字母).
A.容器内气体密度保持不变
B.CO与CO2的物质的量之比保持不变
C.H2O与CO2的生成速率之比为1:1
D.该反应的平衡常数保持不变
(3)已知一些共价键的键能如下:
| 共价键 | H-H | C-H | C-O | O-H |
| 键能(kJ-mol-3) | 436 | 414 | 326 | 464 |
(4)当合成气体中CO与H2的物质的量之比恒定时,温度、压强CO转化率的影响如图1所示.图1中A点的v(逆)<B点的v(正)(填“>”“<”或“=”).说明理由B点对应的温度和压强都比A点高,温度升高,或压强增大,都会加快反应速率.实际工业生产中该合成反应的条件为500℃、4MPa,请回答采用500℃的可能原因500℃时一氧化碳转化率较大,反应速率也较快.若温度过高,一氧化碳转化率降低,若温度过低,反应速率太慢.
(5)一定温度下,密闭容器中发生反应③,水蒸气的转化率与a(H2O)/h(CO)的关系如图2所示,计算该温度下发生反应③的平衡常数K=1.
在图2中作出一氧化碳的转化率n(H2O)/n(CO)的曲线.
| A. | (CH3)2C(Cl)CH2CH3的名称为:2-氯-2-甲基丁烷 | |
| B. | 某烷烃主链含4个碳原子的结构有2种,则与其碳原子个数相同且主链有4个碳原子的单烯烃有4种 | |
| C. | 1mol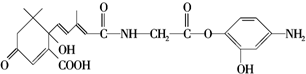 与NaOH溶液反应,最多消耗5molNaOH 与NaOH溶液反应,最多消耗5molNaOH | |
| D. | 1molβ-紫罗兰酮(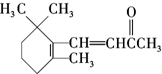 )与1molBr2发生加成反应得到3种不同产物 )与1molBr2发生加成反应得到3种不同产物 |
| A. | 0.5mol的Ba2+ | B. | 0.5mol的H+ | C. | 1.0mol的H+ | D. | 2.0mol的OH- |
| A. | C2H4、C6H6 | B. | CH4、CH2O | C. | C3H8、CH3CH2OH | D. | C2H6、CH3CHO |
| A. | 氧分子的大小发生改变 | B. | 氧分子的质量发生改变 | ||
| C. | 氧分子变成了氧原子 | D. | 氧分子之间的间隔变小了 |

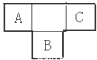 A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等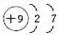 ,用电子式表示C的单质与H2反应的过程:
,用电子式表示C的单质与H2反应的过程: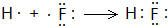 .
.