题目内容
6.中学常见反应的化学方程式有A+B→X+Y+H2O或H2O+A+B→X+Y(未配平,反应条件略去),下列问题所涉及反应是上述两个方程式之一.请回答:(1)常温下,若A为黄绿色气体,B为非金属氧化物,A、B均能使品红溶液褪色,A+B+H2O→X+Y,则该反应的化学方程式为Cl2+SO2+2H2O=2HCl+H2SO4.
(2)若A为金属单质,其与B的浓溶液常温钝化而加热则可以反应,而且所得的三种产物在常温下又可以发生反应,则表现氧化性的B与表现酸性的B的物质的量之比是1:1.
(3)若A为常见的非金属单质,B的溶液为某浓酸,其中A、B的物质的量之比为1:4,而且该反应能产生一种造成光化学烟雾的气体,则该反应化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(4)若A、B均为化合物,Y为白色沉淀(不含金属元素),B为引起温室效应的主要气体,写出B(过量)与A反应生成Y的离子方程式H2O+2CO2+SiO32-=H2SiO3↓+2HCO3-.
(5)若该反应是实验室制取C气体的反应.已知C是无色刺激性气味的气体,其水溶液呈弱碱性.写出该反应的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
分析 (1)A为黄绿色气体,应为Cl2,B为非金属氧化物,A、B均能使品红溶液褪色,则B为SO2,二者反应生成盐酸和硫酸;
(2)若A为金属单质,与B的浓溶液常温钝化而加热则可以反应,而且所得的三种产物在常温下又可以发生反应,应是Fe与浓硫酸反应生成硫酸铁、二氧化硫与水,硫酸铁、二氧化硫与水反应生成硫酸亚铁与硫酸;
(3)若A为常见的非金属单质,B的溶液为某浓酸,其中A、B的物质的量之比为1:4,而且该反应能产生一种造成光化学烟雾的气体,应是碳与浓硝酸反应生成二氧化碳、二氧化氮与水;
(4)若A、B均为化合物,B为引起温室效应的主要气体,B为二氧化碳,Y为白色沉淀(不含金属元素),应为H2SiO3,A、B的反应可溶性硅酸盐和二氧化碳的反应,二氧化碳过量生成硅酸与碳酸氢盐;
(5)若该反应是实验室制取C气体的反应,C是无色刺激性气味的气体,其水溶液呈弱碱性,C为氨气,应是氯化铵与氢氧化钙在加热条件下生成氯化钙、氨气与水.
解答 解:(1)A为黄绿色气体,应为Cl2,B为非金属氧化物,A、B均能使品红溶液褪色,则B为SO2,二者反应生成盐酸和硫酸,反应方程式为:Cl2+SO2+2H2O=2HCl+H2SO4,
故答案为:Cl2+SO2+2H2O=2HCl+H2SO4;
(2)若A为金属单质,与B的浓溶液常温钝化而加热则可以反应,而且所得的三种产物在常温下又可以发生反应,应是Fe与浓硫酸反应生成硫酸铁、二氧化硫与水,硫酸铁、二氧化硫与水反应生成硫酸亚铁与硫酸,A与B反应方程式为:2Fe+6H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O,反应中表现氧化性的硫酸与表现酸性的硫酸的物质的量之比是3:3=1:1,
故答案为:1:1;
(3)若A为常见的非金属单质,B的溶液为某浓酸,其中A、B的物质的量之比为1:4,而且该反应能产生一种造成光化学烟雾的气体,应是碳与浓硝酸反应生成二氧化碳、二氧化氮与水,该反应方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(4)若A、B均为化合物,B为引起温室效应的主要气体,B为二氧化碳,Y为白色沉淀(不含金属元素),应为H2SiO3,A、B的反应可溶性硅酸盐和二氧化碳的反应,二氧化碳过量生成硅酸与碳酸氢盐,反应离子方程式为:H2O+2CO2+SiO32-=H2SiO3↓+2HCO3-,
故答案为:H2O+2CO2+SiO32-=H2SiO3↓+2HCO3-;
(5)若该反应是实验室制取C气体的反应,C是无色刺激性气味的气体,其水溶液呈弱碱性,C为氨气,应是氯化铵与氢氧化钙在加热条件下生成氯化钙、氨气与水,反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
点评 本题考查无机物的推断,侧重于学生的分析能力的考查,注意把握相关无机物的性质以及反应的特征,难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案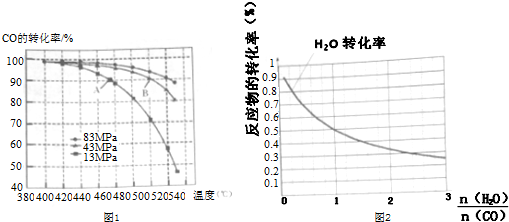
2H2(g)+CO(g)?CH3OH(g)△H=-90.0kJ•mol-1 ①
2CH3OH(g)?CH3OCH3(g)△H=-24.5kJ•mol-1 ②
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.1mol kJ•mol-1 ③
(1)反应①的△S<0(填“>”“<”或“=”),在较低(填“较高”或“较低”)温度下该反应自发进行.
(2)在250℃的恒容密闭容器中,下列事实可以作为反应③已达平衡的是BC(填选项字母).
A.容器内气体密度保持不变
B.CO与CO2的物质的量之比保持不变
C.H2O与CO2的生成速率之比为1:1
D.该反应的平衡常数保持不变
(3)已知一些共价键的键能如下:
| 共价键 | H-H | C-H | C-O | O-H |
| 键能(kJ-mol-3) | 436 | 414 | 326 | 464 |
(4)当合成气体中CO与H2的物质的量之比恒定时,温度、压强CO转化率的影响如图1所示.图1中A点的v(逆)<B点的v(正)(填“>”“<”或“=”).说明理由B点对应的温度和压强都比A点高,温度升高,或压强增大,都会加快反应速率.实际工业生产中该合成反应的条件为500℃、4MPa,请回答采用500℃的可能原因500℃时一氧化碳转化率较大,反应速率也较快.若温度过高,一氧化碳转化率降低,若温度过低,反应速率太慢.
(5)一定温度下,密闭容器中发生反应③,水蒸气的转化率与a(H2O)/h(CO)的关系如图2所示,计算该温度下发生反应③的平衡常数K=1.
在图2中作出一氧化碳的转化率n(H2O)/n(CO)的曲线.
| A. | C2H4、C6H6 | B. | CH4、CH2O | C. | C3H8、CH3CH2OH | D. | C2H6、CH3CHO |
 如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压胶管的胶头,下列与实验事实不相符的是( )
如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压胶管的胶头,下列与实验事实不相符的是( )| A. | NH3(H2O含石蕊) 蓝色喷泉 | B. | Cl2(饱和食盐水) 无色喷泉 | ||
| C. | HCl (H2O含石蕊) 红色喷泉 | D. | SO2(NaOH溶液) 无色喷泉 |
| A. | 中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多于醋酸 | |
| B. | 将氢氧化钠溶液和氨水各稀释一倍,两者的c(OH-)均减少到原来的一半 | |
| C. | 常温下,某溶液中由水电离出的c(OH-)=1×10-10 mol/L,该溶液可能是盐酸 | |
| D. | 如果盐酸的物质的量浓度是醋酸的两倍,则盐酸的c(H+)也是醋酸的两倍 |
| A. | 氧分子的大小发生改变 | B. | 氧分子的质量发生改变 | ||
| C. | 氧分子变成了氧原子 | D. | 氧分子之间的间隔变小了 |
| A. | H2SO4 | B. | NaNO3 | C. | KOH | D. | MgO |
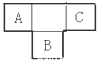 A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等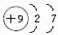 ,用电子式表示C的单质与H2反应的过程:
,用电子式表示C的单质与H2反应的过程: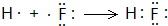 .
. .
.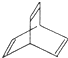 ,X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有2种.有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式:
,X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有2种.有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式: .
.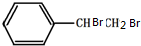 .
. .
.