题目内容
2.有A、B、C三种有机物,B用氢气还原生成D,A的水解产物之一也是D,另一产物与硝酸、硝酸银混合液反应,生成黄色沉淀.B氧化后生成E,C的水解产物之一也是E,另一种产物是D.E既能与碳酸钠溶液反应,又能与银氨溶液反应.(1)结构简式:A是CH3I;B是HCHO;C是HCOOCH3.
(2)化学方程式:B→D是HCHO+H2$\stackrel{催化剂}{→}$CH3OH;A的水解反应是CH3I+NaOH$→_{△}^{水}$CH3OH+NaI.
分析 E既能与碳酸钠溶液反应,又能与银氨溶液反应,说明E为HCOOH,B氧化后生成E,B用氢气还原生成D,则B为HCHO,D为CH3OH,A的水解产物之一也是D,另一产物与硝酸、硝酸银混合液反应,生成黄色沉淀,黄色沉淀为AgI,则A为CH3I,C水解生成CH3OH和HCOOH,说明C为HCOOCH3,据此分析.
解答 解:(1)E既能与碳酸钠溶液反应,又能与银氨溶液反应,说明E为HCOOH,B氧化后生成E,B用氢气还原生成D,则B为HCHO,D为CH3OH,A的水解产物之一也是D,另一产物与硝酸、硝酸银混合液反应,生成黄色沉淀,黄色沉淀为AgI,则A为CH3I,C水解生成CH3OH和HCOOH,说明C为HCOOCH3,
故答案为:CH3I;HCHO;HCOOCH3;
(2)B用氢气还原生成D,则B为HCHO,D为CH3OH,化学方程式为:HCHO+H2$\stackrel{催化剂}{→}$CH3OH,A为CH3I,其水解方程式为:CH3I+NaOH$→_{△}^{水}$CH3OH+NaI,
故答案为:HCHO+H2$\stackrel{催化剂}{→}$CH3OH;CH3I+NaOH$→_{△}^{水}$CH3OH+NaI.
点评 本题考查了有机推断的相关知识,注意各官能团的性质是解题的关键,甲酸既能与碳酸钠溶液反应,又能与银氨溶液反应是解题的突破口.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
12.氢气还原氧化铜:CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$H2O+Cu,在该反应说法不正确的是( )
| A. | H2做还原剂 | B. | CuO做氧化剂 | ||
| C. | 铜元素的化合价降低 | D. | 铜元素化合剂升高 |
13.在一密闭容器中进行如下反应:2SO2(气)+O2(气)═2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
| A. | SO2为0.5mol/L、O2为0.2mol/L | B. | SO2为0.25mol/L | ||
| C. | SO2、SO3均为0.15mol/L | D. | SO3为0.4mol/L |
10.下列有关说法正确的是( )
| A. | 在研究物质微观结构的过程中,科学家先后使用了扫描隧道显微镜、光学显微镜、电子显微镜等观测仪器 | |
| B. | “纳米铜”具有非常强的化学活性,在空气中可以燃烧,因为它比铜片更易失去电子 | |
| C. | 室温离子液体是指在室温或接近室温下呈现的完全由阴、阳离子所组成的盐,(C2H5NH3)NO3可能是其中一种 | |
| D. | 肼、氨、甲醇燃料电池的热值远高于燃料普通燃烧的热值 |
14.将20gM物质、5gN物质、9gR物质混合加热发生化学反应,经充分反应后的混合物中含5gM物质、20gR物质还含有一种新物质Q.若M、N、R、Q的相对分子质量分别为30、20、44、18,它们之间发生反应的化学方程式是( )
| A. | M+N=Q+R | B. | M+2N=2R+Q | C. | 2M+N=2R+Q | D. | 2M+N=R+2Q |
16.二甲醛是一种重要的化工原料,利用水煤气(CO、H2)合成二甲醛是工业上的常用方法,该方法由以下几步组成:

2H2(g)+CO(g)?CH3OH(g)△H=-90.0kJ•mol-1 ①
2CH3OH(g)?CH3OCH3(g)△H=-24.5kJ•mol-1 ②
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.1mol kJ•mol-1 ③
(1)反应①的△S<0(填“>”“<”或“=”),在较低(填“较高”或“较低”)温度下该反应自发进行.
(2)在250℃的恒容密闭容器中,下列事实可以作为反应③已达平衡的是BC(填选项字母).
A.容器内气体密度保持不变
B.CO与CO2的物质的量之比保持不变
C.H2O与CO2的生成速率之比为1:1
D.该反应的平衡常数保持不变
(3)已知一些共价键的键能如下:
运用反应①计算一氧化碳中碳氧共价键的键能1070kJ•mol-1.
(4)当合成气体中CO与H2的物质的量之比恒定时,温度、压强CO转化率的影响如图1所示.图1中A点的v(逆)<B点的v(正)(填“>”“<”或“=”).说明理由B点对应的温度和压强都比A点高,温度升高,或压强增大,都会加快反应速率.实际工业生产中该合成反应的条件为500℃、4MPa,请回答采用500℃的可能原因500℃时一氧化碳转化率较大,反应速率也较快.若温度过高,一氧化碳转化率降低,若温度过低,反应速率太慢.
(5)一定温度下,密闭容器中发生反应③,水蒸气的转化率与a(H2O)/h(CO)的关系如图2所示,计算该温度下发生反应③的平衡常数K=1.
在图2中作出一氧化碳的转化率n(H2O)/n(CO)的曲线.

2H2(g)+CO(g)?CH3OH(g)△H=-90.0kJ•mol-1 ①
2CH3OH(g)?CH3OCH3(g)△H=-24.5kJ•mol-1 ②
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.1mol kJ•mol-1 ③
(1)反应①的△S<0(填“>”“<”或“=”),在较低(填“较高”或“较低”)温度下该反应自发进行.
(2)在250℃的恒容密闭容器中,下列事实可以作为反应③已达平衡的是BC(填选项字母).
A.容器内气体密度保持不变
B.CO与CO2的物质的量之比保持不变
C.H2O与CO2的生成速率之比为1:1
D.该反应的平衡常数保持不变
(3)已知一些共价键的键能如下:
| 共价键 | H-H | C-H | C-O | O-H |
| 键能(kJ-mol-3) | 436 | 414 | 326 | 464 |
(4)当合成气体中CO与H2的物质的量之比恒定时,温度、压强CO转化率的影响如图1所示.图1中A点的v(逆)<B点的v(正)(填“>”“<”或“=”).说明理由B点对应的温度和压强都比A点高,温度升高,或压强增大,都会加快反应速率.实际工业生产中该合成反应的条件为500℃、4MPa,请回答采用500℃的可能原因500℃时一氧化碳转化率较大,反应速率也较快.若温度过高,一氧化碳转化率降低,若温度过低,反应速率太慢.
(5)一定温度下,密闭容器中发生反应③,水蒸气的转化率与a(H2O)/h(CO)的关系如图2所示,计算该温度下发生反应③的平衡常数K=1.
在图2中作出一氧化碳的转化率n(H2O)/n(CO)的曲线.
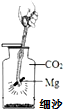 《消防知识手册》指出:活泼金属(如镁)燃烧引发的火灾不能用二氧化碳灭火.小明想:是不是活泼金属能与二氧化碳反应?他向老师要来镁带、一集气瓶的二氧化碳气体和必要的器材,在老师指导下按照如图所示进行实验.请回答下列问题.
《消防知识手册》指出:活泼金属(如镁)燃烧引发的火灾不能用二氧化碳灭火.小明想:是不是活泼金属能与二氧化碳反应?他向老师要来镁带、一集气瓶的二氧化碳气体和必要的器材,在老师指导下按照如图所示进行实验.请回答下列问题.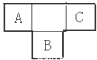 A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等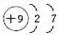 ,用电子式表示C的单质与H2反应的过程:
,用电子式表示C的单质与H2反应的过程: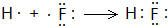 .
.