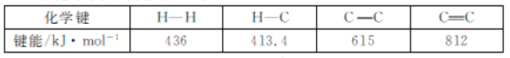
题目内容
【题目】室温下,向10 mL 0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中粒子的数目减小
B.再加入CH3COONa固体能促进醋酸的电离
C.醋酸的电离程度增大,c(H+)亦增大
D.溶液中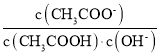 不变
不变
【答案】D
【解析】
A. 加水稀释醋酸的过程中,醋酸的电离程度增大,但溶液中c(H+)减小。由于KW不变,则c(OH-)增大,即溶液中OH-数目增多,故A错误;
B. 再加入CH3COONa固体,c(CH3COO-)增大,能抑制CH3COOH的电离,故B错误;
C. 加水稀释醋酸的过程中,醋酸的电离程度增大,但溶液中c(H+)减小,故C错误;
D. 醋酸的电离平衡常数K=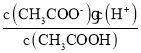 ,则
,则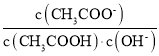 =
=![]() ,温度不变,电离平衡常数不变,KW不变,
,温度不变,电离平衡常数不变,KW不变,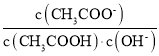 不变,故D正确;
不变,故D正确;
正确答案是D。

 53随堂测系列答案
53随堂测系列答案【题目】兴趣小组探究锌片与盐酸、醋酸反应时,浓度或温度对反应速率的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、0.10mol/LCuCl2、锌片(形状、大小、质量相同)、秒表、碳棒、导线、烧杯、几支试管和胶头滴管,酸液温度控制为298K和308K。
酸液都取足量、相同体积,请你帮助完成下面实验设计表(表中不留空格):
实验编号 | 温度(K) | 盐酸浓度 | 醋酸浓度 | 实验目的 |
① | 298 | 0.20mol/L |
| a.实验①和②是探究_____对锌与盐酸反应速率的影响; b.实验①和③是探究_____对锌与盐酸反应速率的影响; c.实验①和④是探究相同温度下,相同 浓度的盐酸、醋酸与锌反应速率的区别 |
② | 308 | 0.20mol/L |
| |
③ | 298 | 0.40mol/L |
| |
④ | ______ |
| 0.20mol/L |
(2)若(1)中实验①锌片消失的时间是20s,则锌片剩余质量与时间关系图如下图:
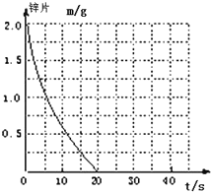
假设:该反应温度每升高10℃,反应速率是原来的2倍;温度相同、浓度相同时,醋酸的平均反应速度是盐酸的1/2.请你在此图中大致画出“实验②”(用实线)、“实验④中醋酸实验”(用虚线)的锌片质量与时间关系曲线.____________________________
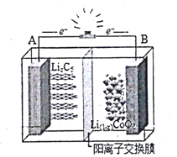
(3)某实验小组在做(1)中实验④时误加少量0.10mol/LCuCl2溶液,发现反应速率与(1)中实验①接近,加少量0.10mol/LCuCl2溶液后速率变快的原因是_________________。