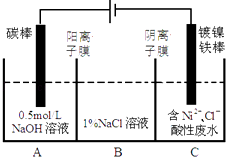
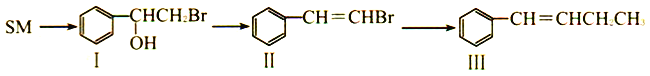题目内容
【题目】SO2是主要大气污染物之一,工业上可用如下装置吸收转化SO2(A、B为惰性电极)。下列说法正确的是

A. 电子流动方向为:B→b→a→A
B. a、A极上均发生氧化反应
C. 离子交换膜为阳离子交换膜
D. B极上的电极反应式为:SO2+2eˉ+2H2O=SO42-+4H+
【答案】C
【解析】根据图示可知,SO2→H2SO4,硫元素化合价升高,发生氧化反应,所以B为电解池的阳极,A为电解池的阴极,a为电源的负极;电子由负极流向正极,因此电子流动方向为a→A→B→b,A错误;a为电源的负极,发生氧化反应,A为电解池的阴极,发生还原反应,B错误;该电解池中阴极发生还原反应:2SO32-+2e-+ 4H+ =S2O42-+ 2H2O,阳极发生氧化反应:SO2-2e-+2H2O ===4H++SO42-,反应需要氢离子,因此离子交换膜为阳离子交换膜,C正确;B为电解池的阳极,失电子:SO2-2e-+2H2O ===4H++SO42-,D错误;正确选项C。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案【题目】今有室温下四种溶液,有关叙述不正确的是( )
① | ② | ③ | ④ | |
浓度c/mol/L | 0.1 | 0.1 | 0.1 | 0.1 |
溶液 | 氨水 | CH3COONa溶液 | 醋酸 | 盐酸 |
A.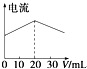 在20 mL ①溶液中逐滴加入③溶液,溶液导电能力变化如图
在20 mL ①溶液中逐滴加入③溶液,溶液导电能力变化如图
B.②、③两溶液等体积混合,离子浓度:2c(Na+)=c(CH3COO﹣)+c(CH3COOH)
C.①、④两溶液等体积混合,离子浓度:c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣)
D.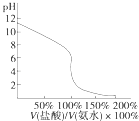 用④滴定①,滴定曲线如图,可用酚酞作指示剂
用④滴定①,滴定曲线如图,可用酚酞作指示剂
【题目】在2L密闭容器中,800℃时反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K= , 已知:K(300℃)>K(350℃),该反应是反应(填“放热”或“吸热”).
(2)图中表示NO2的变化的曲线是 , 用O2的浓度变化表示从0~2s内该反应的平均速率v= . 
(3)能说明该反应已经达到平衡状态的是 a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是 a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂.