题目内容
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是
A.甲的相对分子质量比乙的相对分子质量小B.甲的摩尔体积比乙的摩尔体积小
C.甲的分子数比乙的分子数少D.甲中所含的原子数比乙中的所含的原子数少
【答案】C
【解析】
在两个密闭容器中,若两容器的温度和压强均相同,根据理想气体方程PV=nRT可知,气体体积和物质的量成正比,据此回答问题。
根据理想气体方程PV=nRT可知,带入质量公式m=nM和m=![]() ,
,![]() ,整理公式可得
,整理公式可得![]() ,即同温同压下,气体密度与气体摩尔质量成正比。
,即同温同压下,气体密度与气体摩尔质量成正比。
A. 甲的密度大于乙的密度,即甲的相对分子质量比乙的相对分子质量大,A错误;
B. 在同温同压下,气体的摩尔体积相等,B错误;
C. 两气体等质量,甲的相对分子质量比乙的相对分子质量大,即物质的量甲比乙小,故甲的分子数比乙的分子数少,C正确;
D. 甲的分子数比乙的分子数少,但是原子数涉及到分子的组成,题目信息无法判断,D错误;
答案为C。

【题目】CO、H2是煤的气化产物,在生产生活中用途广泛。
(1)CO还原法处理大气污染物SO2
①2CO(g) + SO2(g) ![]() S(s)+2CO2(g) H = -270 kJ·mol-1,该反应的平衡常数表达式为__。
S(s)+2CO2(g) H = -270 kJ·mol-1,该反应的平衡常数表达式为__。
②在绝热恒容的密闭容器中进行上述反应,下列说法正确的是_____。
a 若混合气体密度保持不变,则已达平衡状态
b 达平衡后若再充人一定量CO2,平衡常数保持不变
c 分离出部分S,正、逆反应速率均保持不变,平衡不移动
d 从反应开始到平衡,容器内气体的压强保持不变
③向2 L恒温恒容密闭容器中通人2 mol CO、1 mol SO2,分别进行a、b、c三组实验。在不同催化剂件下发生反应:2CO(g) + SO2(g) ![]() S(s)+2CO2(g) H = -270 kJ·mol-1,反应体系总压随时间的变化如下表所示,则三组实验温度的大小关系是_____(用a、b、c表示),实验a从反应开始至45s达到平衡,则该过程反应速率v(SO2)__________(结果保留2位有效数字)。
S(s)+2CO2(g) H = -270 kJ·mol-1,反应体系总压随时间的变化如下表所示,则三组实验温度的大小关系是_____(用a、b、c表示),实验a从反应开始至45s达到平衡,则该过程反应速率v(SO2)__________(结果保留2位有效数字)。
| 0s | 40s | 45s | 60s |
a | 175 | 142 | 140 | 140 |
b | 160 | 120 | 120 | 120 |
c | 160 | 130 | 125 | 120 |
(2)利用CO、H2可制备天然气,主要反应为:
CO(g) + 3H2(g) ![]() CH4(g) + H2O(g) H1=-206.2 kJ·mol1;
CH4(g) + H2O(g) H1=-206.2 kJ·mol1;
CO(g) + H2O(g) ![]() CO2(g) + H2(g) H2 = -41.0 kJ·mol-1;
CO2(g) + H2(g) H2 = -41.0 kJ·mol-1;
H2O(l) ═H2O(g) H3 =+44 kJ·mol-1 。
回答下列问题:
①反应CO2(g) + 4H2(g) ![]() CH4(g) + 2H2O(l) 的H4 = ________ kJ·mol-1。某温度下,分别在起始容积相同的恒压容器A、恒容容器B中加人1molCO2和4molH2的混合气体,两容器反应达到平衡后放出或吸收的热量较多的是__( 填“A”或“B")。
CH4(g) + 2H2O(l) 的H4 = ________ kJ·mol-1。某温度下,分别在起始容积相同的恒压容器A、恒容容器B中加人1molCO2和4molH2的混合气体,两容器反应达到平衡后放出或吸收的热量较多的是__( 填“A”或“B")。
②在恒压管道反应器中按n(H2):n(CO) = 3:1通入原料气,在催化剂作用下制备合成天然气,400 ℃ p总为100 kPa时反应体系平衡组成如下表所示:
组分 | CH4 | H2O | H2 | CO2 | CO |
体积分数/% | 45.0 | 42.5 | 10.0 | 1.50 | 1.00 |
则该条件下CO的总转化率α=____。![]()
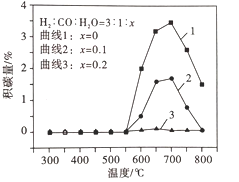
③制备合成天然气采用在原料气中通入水蒸气来缓解催化剂积碳。
积碳反应为:反应I :CH4(g) ![]() C(s) + 2H2(g) H = +75 kJ·mol-1;
C(s) + 2H2(g) H = +75 kJ·mol-1;
反应Ⅱ:2CO(g) ![]() C(s) + CO2(g) H = -172 kJ·mol-1,
C(s) + CO2(g) H = -172 kJ·mol-1,
平衡体系中水蒸气浓度对积碳量的影响如图所示,下列说法正确的是__。
A 曲线1在700 ~ 800℃积碳量减小的原因可能是反应Ⅱ逆向移动
B 曲线1在550 ~700℃积碳量增大的原因可能是反应I、Ⅱ的速率增大
C 曲线2、3在550 ~800℃积碳量较低的原因是水蒸气稀释作用使积碳反应速率减小
D 水蒸气能吸收反应放出的热量,降低体系温度至550℃以下,有利于减少积碳