题目内容
4.如图1是某化学兴趣小组进行丁烷裂解的实验流程.(注:CuO能将烃氧化成CO2和H2O,G后面装置与答题无关,铁架台等已省略.)按图连好装置后,需进行的实验操作有:①给D、G装置加热;②检查整套装置的气密性;③排出装置中的空气等…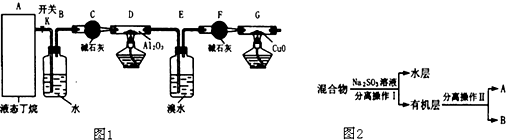
(1)这三步操作的先后顺序依次是②③①
(2)B装置所起的作用是通过观察气泡,调节K,控制气体流速
(3)假定丁烷按C4H10→C2H6+C2H4和C4H10→CH4+C3H6的方式完全裂解,当(E+F)装置的总质量比反应前增加了0.7g,G装置的质量减少了1.76g,则丁烷的裂解产物中,甲烷与乙烷的物质的量之比为1:1(假定流经D、G装置中的气体能完全反应)
(4)若对E装置中的混合物再按图2流程实验:
①分离操作Ⅰ和Ⅱ的名称分别是:Ⅰ分液分液Ⅱ蒸馏
Na2SO3溶液的作用是(用离子方程式表示)SO2+Br2+2H2O=SO42-+2Br-+4H+
②已知B的碳原子数大于A的碳原子数,请写出B的结构简式CH2BrCHBrCH3.
分析 (1)先检验气密性,赶出内部气体,再加热;
(2)通过观察气泡,控制气体流速;
(3)E、F吸收的是烯烃,G减少的质量是氧化铜中的氧元素质量,丁烷的裂解中,生成乙烯的物质的量和乙烷的物质的量相等,甲烷和丙烯的物质的量相等,再结合原子守恒计算甲烷和乙烷的物质的量之比;
(4)混合物中含有单质溴、水、1,2-二溴乙烷、1,2-二溴丙烷,加入亚硫酸钠,亚硫酸钠被溴氧化生成硫酸钠,同时生成NaBr,从而除去单质溴,1,2-二溴乙烷、1,2-二溴丙烷都不溶于水,溶液分层,采用分液的方法分离出混合物和有机层,互溶的1,2-二溴乙烷、1,2-二溴丙烷采用蒸馏的方法分离,分离出A和B,而B的碳原子数大于A的碳原子数可区分A和B;
解答 解:(1)先检验气密性,赶出内部气体,再给D、G装置加热;
故答案为:②③①;
(2)B装置所起的作用是通过观察气泡,控制气体流速;
故答案为:通过观察气泡,调节K,控制气体流速;
(3)丁烷的裂解中生成的乙烯和乙烷的物质的量相等,生成的甲烷和丙烯的物质的量相等,E、F吸收的是烯烃,G减少的质量是氧化铜中的氧元素质量,设x为C2H4的物质的量,y为C3H6的物质的量,则乙烷和甲烷的物质的量分别是x、y,则:
28x+42y=0.7g;
乙烷、甲烷与氧化铜反应需要的氧原子的物质的量为:
x×(2+1.5)×2+y×2×2=$\frac{1.76}{16}$,
解得:x=y=0.01mol
故答案为:1:1;
(4)混合物中含有单质溴、水、1,2-二溴乙烷、1,2-二溴丙烷,加入亚硫酸钠,亚硫酸钠被溴氧化生成硫酸钠,同时生成NaBr,从而除去单质溴,1,2-二溴乙烷、1,2-二溴丙烷都不溶于水,溶液分层,采用分液的方法分离出混合物和有机层,互溶的1,2-二溴乙烷、1,2-二溴丙烷采用蒸馏的方法分离,分离出A和B,而B的碳原子数大于A的碳原子数可区分A和B;
①通过以上分析知,分离操作Ⅰ和Ⅱ的名称分别是:Ⅰ分液、Ⅱ蒸馏,亚硫酸钠具有还原性,能和强氧化性物质溴反应而除去溴,离子方程式为:SO2+Br2+2H2O=SO42-+2Br-+4H+,
故答案为:分液;蒸馏;SO2+Br2+2H2O=SO42-+2Br-+4H+;
②已知B的碳原子数大于A的碳原子数,说明B中碳原子个数是3、A中碳原子个数是2,B为1,2-二溴丙烷,B的结构简式CH2BrCHBrCH3.
故答案为:CH2BrCHBrCH3.
点评 本题以丁烷裂解为载体考查实验基本操作、计算、物质的分离和提纯,明确流程图中各个装置的作用、物质分离和提纯方法的选取等知识点即可解答,难点是(3)题计算,明确质量增加的量和质量减少的量分别是什么物质是解(5)的关键,题目难度中等.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案| A. | 镁离子的电子式Mg2+ | B. | Cl的结构示意图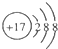 | ||
| C. | 氯离子的电子式Cl- | D. | 质量数为37的氯原子 ${\;}_{37}^{17}$Cl |
| A. | CaCl2 | B. | Ne | C. | Br2 | D. | Na2O |
| A. | 0.1 mol•L-1的NaOH溶液:K+、Na+、SO42-、CO32- | |
| B. | 0.1 mol•L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1 mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
| 实验方案 | 实验现象 |
| ①用砂纸摩擦后的镁带与沸水反应,再向反应 应后溶液中滴加酚酞 | A、浮于水面,熔成一个小球,在水面上无定向移 动,随之消失,溶液变红色 |
| ②钠与滴有酚酞试液的冷水反应 | B、产生气体,可在空气中燃烧,溶液变成浅红色 |
| ③镁条与2mol•L-1的盐酸反应 | C、反应不十分强烈,产生无色气体 |
| ④铝条与2mol•L-1的盐酸反应 | D、剧烈反应,产生无色气体 |
| ⑤向AlCl3溶液中滴加NaOH溶液至过量 | E、生成白色胶状沉淀,继而沉淀消失 |
(1)实验目的验证第三周期金属元素的金属性的递变规律.
(2)实验用品:
仪器:试管、酒精灯、砂纸、镊子、小刀、胶头滴管、滤纸
药品:镁带、钠、铝条、2mol•L-1的盐酸、NaOH溶液、蒸馏水、酚酞、AlCl3溶液
(3)实验内容:(填写题给信息表中的序号)
| 实验方案 | 实验现象(填写序号) |
| ① | B |
| ② | A |
| ③ | D |
| ④ | C |
| ⑤ | E |
(5)为了用实验的方法验证镁和铝的金属性强弱,学生乙设计了一种不同于学生甲的方法:
学生甲:用2mol•L-1盐酸作试剂,比较镁和铝与盐酸反应的情况
学生乙:用水作试剂,比较镁和铝与水反应的情况
试判断学生乙的设计方案是否合理不合理,原因是常温下镁和铝几乎不和水发生反应,而和酸反应较明显.
| A. | 氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物 | |
| B. | 可逆反应达到平衡后,正、逆反应速率均为0 | |
| C. | 2 mol SO2 与1 mol O2混合一定能生成2 mol SO3 | |
| D. | 使用催化剂不一定能加大反应速率 |
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- | |
| B. | 明矾溶液中滴加Ba(OH)2溶液至SO42-完全沉淀:Al3++Ba2++SO42-+3OH-═BaSO4↓+Al(OH)3↓ | |
| C. | 200 mL 2 mol/L的FeBr2溶液中通入11.2 L标准状况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
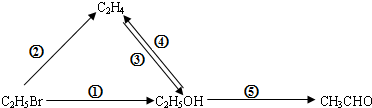
| 选项 | 反应 | 类型 | 反应条件 |
| A | ① | 取代反应 | 氢氧化钠的乙醇溶液、加热 |
| B | ② | 消去反应 | 浓硫酸、加热至170℃ |
| C | ③ | 加成反应 | 催化剂、加热 |
| D | ⑤ | 取代反应 | Cu或Ag作催化剂、加热 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 蛋白质 | B. | 蔗糖 | C. | 葡萄糖 | D. | 淀粉 |