题目内容
16.下列反应的离子方程式正确的是( )| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- | |
| B. | 明矾溶液中滴加Ba(OH)2溶液至SO42-完全沉淀:Al3++Ba2++SO42-+3OH-═BaSO4↓+Al(OH)3↓ | |
| C. | 200 mL 2 mol/L的FeBr2溶液中通入11.2 L标准状况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
分析 A.二氧化碳过量反应生成碳酸氢根离子;
B.硫酸根离子完全沉淀时,铝离子与氢氧根离子的物质的量之比为1:4,反应产物为偏铝酸钠;
C.二价铁离子还原性强于溴离子,氯气先氧化二价铁离子;
D.碱性溶液中不能生成氢离子.
解答 解:A.偏铝酸钠溶液中通入过量二氧化碳,反应生成了氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故A错误;
B.明矾溶液中滴加Ba(OH)2至SO42-完全沉淀,铝离子恰好反应生成偏铝酸根离子,离子方程为:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,故B错误;
C.200 mL 2 mol/L的FeBr2溶液中通入11.2 L标准状况下的氯气,离子方程式:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl-,故C正确;
D.强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4,离子方程式为3ClO-+2Fe(OH)3+4OH-═2FeO42-+3Cl-+5H2O,故D错误;
故选:C.
点评 本题考查了离子方程式的书写判断,注意掌握离子方程式的书写原则,注意反应物用量对反应的影响,题目难度中等.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
6.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应3A(g)+B(g)?xC(g)+2D(g),经5min后测得D的浓度为0.5mol•L-1,c(A):c(B)=3:5,用C的浓度变化表示的平均反应速率为0.1mol•L-1•min-1.下列有关结论正确的是( )
| A. | x的值为1 | |
| B. | 用B的浓度变化表示的平均反应速率为0.2 mol•L-1•min-1 | |
| C. | 反应开始前A的物质的量为3 mol | |
| D. | 5 min时A的浓度为0.2 mol•L-1 |
8.下列反应的离子方程式书写正确的是( )
| A. | 硫酸铝溶液中加入过量氨水 Al3++30H-═Al(OH)3↓ | |
| B. | 向NH4HSO4溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全Ba2++H++OH-+SO42-═BaSO4↓+H2O | |
| C. | CuSO4溶液与少量的Ba(OH)2溶液:Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓ | |
| D. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 Fe2++2H++H2O2═Fe3++2H2O |
5.下列说法正确的是( )
| A. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 | |
| B. | 用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率 | |
| C. | 制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 | |
| D. | 实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 |
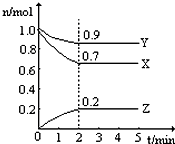 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
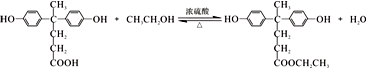
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: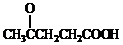 )合成聚芳酯E的路线:
)合成聚芳酯E的路线: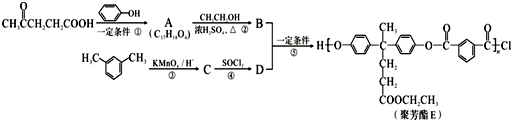
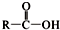 +SOCl2→
+SOCl2→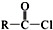 +SO2+HCl
+SO2+HCl +R′OH→
+R′OH→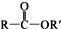 +HCl (R、R′表示烃基)
+HCl (R、R′表示烃基)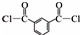 .
. .
. 结构
结构 .
.