题目内容
19.做同周期元素性质递变规律实验时,学生甲设计了一套实验方案,并记录了有关实验现象如下表:| 实验方案 | 实验现象 |
| ①用砂纸摩擦后的镁带与沸水反应,再向反应 应后溶液中滴加酚酞 | A、浮于水面,熔成一个小球,在水面上无定向移 动,随之消失,溶液变红色 |
| ②钠与滴有酚酞试液的冷水反应 | B、产生气体,可在空气中燃烧,溶液变成浅红色 |
| ③镁条与2mol•L-1的盐酸反应 | C、反应不十分强烈,产生无色气体 |
| ④铝条与2mol•L-1的盐酸反应 | D、剧烈反应,产生无色气体 |
| ⑤向AlCl3溶液中滴加NaOH溶液至过量 | E、生成白色胶状沉淀,继而沉淀消失 |
(1)实验目的验证第三周期金属元素的金属性的递变规律.
(2)实验用品:
仪器:试管、酒精灯、砂纸、镊子、小刀、胶头滴管、滤纸
药品:镁带、钠、铝条、2mol•L-1的盐酸、NaOH溶液、蒸馏水、酚酞、AlCl3溶液
(3)实验内容:(填写题给信息表中的序号)
| 实验方案 | 实验现象(填写序号) |
| ① | B |
| ② | A |
| ③ | D |
| ④ | C |
| ⑤ | E |
(5)为了用实验的方法验证镁和铝的金属性强弱,学生乙设计了一种不同于学生甲的方法:
学生甲:用2mol•L-1盐酸作试剂,比较镁和铝与盐酸反应的情况
学生乙:用水作试剂,比较镁和铝与水反应的情况
试判断学生乙的设计方案是否合理不合理,原因是常温下镁和铝几乎不和水发生反应,而和酸反应较明显.
分析 (1)从题意和所做实验分析;
(3)从实验现象和发生的反应思考;
(4)从反应现象对比分析;
(5)Mg与沸水发生微弱反应,Al与水不反应.
解答 解:(1)根据题意“某同学做同周期元素性质递变规律实验时”以及所做实验可以判断,本实验的实验目的是:验证第三周期金属元素的金属性的递变规律.
故答案为:验证第三周期金属元素的金属性的递变规律;
(3)①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞,其现象应是:有气体产生,产生的气体可在空气中燃烧,溶液变成浅红色,即B.
②钠与滴有酚酞试液的冷水反应,反应方程式是2Na+H2O═2NaOH+H2↑,其离子方程式是2Na+H2O═2Na-+2OH-+H2↑,其现象应该是:浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变成红色,即A.
③镁带与2mol/L的盐酸反应,其现象应是:剧烈反应,产生的气体可以在空气中燃烧,即D.值得注意的是镁比铝活泼,因此与盐酸反应,镁比铝剧烈.
④铝条与2mol/L的盐酸反应,其化学方程式是2Al+6HCl═2AlCl3+3H2↑,即离子方程式是2Al+6H+═2Al3++3H2↑,其现象是:反应不十分剧烈,产生的气体可以在空气中燃烧,即C.
⑤向氯化铝溶液中滴加氢氧化钠溶液至过量,其现象:生成氢氧化铝白色胶状沉淀,继而在氢氧化钠过量时氢氧化铝与氢氧化钠反应使沉淀消失,即E.
故答案为:①B; ②A;③D;④C;⑤E;
(4)根据实验①②,说明与水反应时钠比镁剧烈,即钠的金属性比镁强.根据③④,说明与同浓度的盐酸反应,铝比镁剧烈,即铝的金属性比镁强.⑤说明氢氧化铝既能与酸反应,又能与碱反应,即氢氧化铝既有酸性又有碱性,因此铝既有金属性又有非金属性.由以上分析第三周期,金属元素的金属性由强到弱的顺序是:Na>Mg>Al,即同周期从左到右元素的金属性逐渐减弱.故答案为;同周期从左到右元素的金属性逐渐减弱;
(5)Mg与沸水发生微弱反应,Al与水不反应,与冷水都不反应,故答案为:不合理;常温下镁和铝几乎不和水发生反应,而和酸反应较明显.
点评 本题把金属元素的性质与实验结合起来,探究同周期元素金属性的递变规律,具有较大的思维容量,能较好地训练学生比较、归纳、分析、思考的能力.题目难度不大.

| A. | 同一支钢笔使用不同品牌墨水时,容易发生堵塞现象 | |
| B. | 当日光从窗隙射入灰尘飞扬的房间时,可观察到一束光线 | |
| C. | 明矾具有净水作用 | |
| D. | 向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀 |
| A. | 硫酸铝溶液中加入过量氨水 Al3++30H-═Al(OH)3↓ | |
| B. | 向NH4HSO4溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全Ba2++H++OH-+SO42-═BaSO4↓+H2O | |
| C. | CuSO4溶液与少量的Ba(OH)2溶液:Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓ | |
| D. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 Fe2++2H++H2O2═Fe3++2H2O |
| A. | 卤素单质与水反应的通式为X2+H2O?HX+HXO | |
| B. | HX都极易溶于水,它们的热稳定性随核电荷数增大而增强 | |
| C. | 卤素单质的颜色随相对分子质量增大的顺序而加深 | |
| D. | X-的还原性随卤素的核电荷数增大而增强,核电荷数小的卤素单质可将核电荷数大的卤素从它的盐溶液里置换出来 |
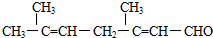 ,若要检验出其中的碳碳双键,方法是先加足量的银氨溶液使醛基氧化,然后再加入酸性的KMnO4溶液,若酸性KMnO4溶液的紫色褪去,证明有碳碳双键存在.
,若要检验出其中的碳碳双键,方法是先加足量的银氨溶液使醛基氧化,然后再加入酸性的KMnO4溶液,若酸性KMnO4溶液的紫色褪去,证明有碳碳双键存在.
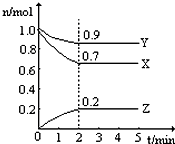 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: