题目内容
向2L密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质的物质的量随时间变化如图甲所示[t0~15 s阶段n(B)未画出]。图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段所改变的外界条件均不同。已知t3~t4阶段为使用催化剂。观察下图,回答以下问题: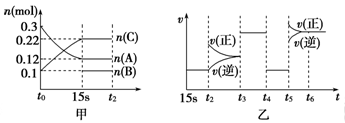
(1)甲图中从反应至达到平衡状态,生成物C的平均反应速率为____________________。
(2)图乙中t2时引起平衡移动的条件是______,t5时引起平衡移动的条件是_______。(填序号)
A.升高温度 B.增大反应物浓度 C.使用催化剂 D.减少体系压强
(3)图乙中表示平衡混合物中,在这四个阶段中C的物质的量最高的一段时间是______。(填序号): A.15s-t2时段 B.t3-t4时段 C.t4-t5时段 D.t6以后
(4)该反应的化学方程式可以表示为:_______________________________________________________,
正反应为______________(填“放热”或“吸热”)反应。
(5)反应开始时加入的B的物质的量为________________。
(1) 0.004mol·L-1·s-1 (2)B A (3) D
(4) 3A(g)  B(g)+2C(g) 吸热 (5) 0.04mol
B(g)+2C(g) 吸热 (5) 0.04mol
解析试题分析:(1)根据甲图可知,反应进行到15s时达到平衡状态,此时C的物质的量增加了0.22mol-0.10mol=0.12mol,则其浓度变化量为0.12mol÷2L=0.06mol/L,所以从反应至达到平衡状态,生成物C的平均反应速率为0.06mol/L÷15s=0.004mol/(L·s)。
(2)根据乙图可知,t2时正反应速率瞬间增大,而逆反应速率逐渐增大,平衡向正反应方向移动,所以改变的条件应该是增大反应物的浓度,答案选B;同样根据乙图可知,t5时正逆反应速率均增大,但正反应速率大于逆反应速率,平衡向正反应方向移动。由于四个阶段所改变的外界条件均不同,而t2时改变的条件是增大反应物浓度,t3~t4阶段为使用催化剂,t4-t5阶段正逆反应速率减小相同的倍数,平衡不移动,因此改变的条件只能是降低越强,这说明反应前后体积不变。所以t5时引起平衡移动的条件就只能是升高温度,答案选A。
(3)根据(2)中分析可知,从t2开始平衡是向正反应方向移动的,t3、t4时平衡不移动,t5时平衡又向正反应方向移动,所以在这四个阶段中C的物质的量最高的一段时间是t6以后,答案选D。
(4)根据(2)中分析可知,该反应前后体积不变,又因为根据甲图可知,平衡时A、C的物质的量变化量分别为0.18mol、0.12mol,即二者的变化量之比是3:2,其中A是反应物,C是生物,这说明B也一定是生成物,所以该反应的化学方程式可以表示为3A(g)  B(g)+2C(g)。升高温度平衡向正反应方向移动,因此正方应是吸热反应。
B(g)+2C(g)。升高温度平衡向正反应方向移动,因此正方应是吸热反应。
(5)平衡时生成C的物质的量是0.12mol,则根据反应方程式3A(g)  B(g)+2C(g)可知,生成B的物质的量是0.06mol。根据甲图可知,平衡时B的物质的量是0.1mol,所以反应开始时加入的B的物质的量为0.1mol-0.06mol=0.04mol。
B(g)+2C(g)可知,生成B的物质的量是0.06mol。根据甲图可知,平衡时B的物质的量是0.1mol,所以反应开始时加入的B的物质的量为0.1mol-0.06mol=0.04mol。
考点:考查反应速率、反应热的计算、外界条件对平衡状态的影响以及图像识别等

 小学课时特训系列答案
小学课时特训系列答案氮是地球上含量丰富的一种元素,氮及其化合物在工 农业生产、生活中有着重要作用, 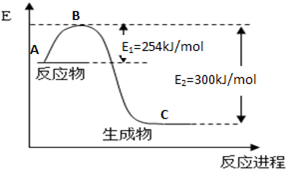
(1)上图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式: 。
(2)若已知下列数据:
| 化学键 | H-H | N≡N |
| 键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N-H的键能 kJ·mol-1。
(3)合成氨反应通常用铁触媒作催化剂。使用铁触媒后E1和E2的变化是:E1 ,E2______,
△H (填“增大”、“减小”、“不变”)。
(4)用NH3催化还原NOX还可以消除氮氧化物的污染。例如
4NH3(g)+3O2(g)= 2N2(g)+6H2O(g) ;△H1=akJ·mol-1
N2(g)+O2(g)=2NO(g); △H2=bkJ/mol
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3= kJ/mol(用含a、b的式子表示)。
二甲醚是—种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的气化的主要化学反应方程式为_______________________________________。
(2)煤的气化过程中产生的有害气体用溶液吸收,生成两种酸式盐,该反应的
化学方程式为__________________________________________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g);△H=-90.8kJ·mol-1
CH3OH(g);△H=-90.8kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g);△H=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g);△H=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g);△H=-41.3kJ·mol-1
CO2(g)+H2(g);△H=-41.3kJ·mol-1
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H= ;
CH3OCH3(g)+CO2(g)的△H= ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是
________________(填字母代号)。
a.高温b.加入催化剂c.减少CO2的浓度d.增加CO的浓度e.分离出二甲醚
(4)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。
此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L) | 0.44 | 0.6 | 0.6 |
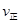 _______
_______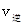 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②若加入CH3OH后,经l0min反应达到平衡,此时c(CH3OH)=__________;该时
间内反应速率v(CH3OH)=__________________。
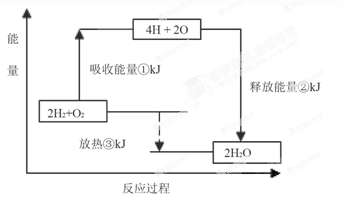
 N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
 2K2CO3+6H2O
2K2CO3+6H2O CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol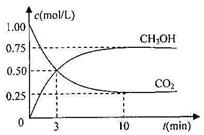
 SO3(g) K1,CO(g)+1/2O2(g)
SO3(g) K1,CO(g)+1/2O2(g)