题目内容
(1)已知热化学方程式:
4Al(s) + 3O2(g) = 2Al2O3 (s) ΔH1=-3288.6 kJ·mol-1,
4Fe(s) + 3O2 (g) =2Fe2O3 (s) ΔH2=-1631.8 kJ·mol-1,
则铝粉与氧化铁发生铝热反应的热化学方程式为 。
(2)已知标准状况下44.8L氢气燃烧生成液态水时放出571.6KJ的热量,氢气的燃烧热为 ;又已知1mol液态水变成气态时需要吸收44KJ的热量,则标准状况下22.4L氢气燃烧生成气态水的热化学方程式为 。
2Al(s)+ Fe2O3 (s)= Al2O3 (s)+2 Fe(s),ΔH=-828.4kJ/mol;285.8kJ/mol H2(g)+1/2O2(g)=H2O(g),ΔH=-241.8kJ/mol
解析试题分析:(1)①Fe(s)+1/2O2(g)=FeO(s)△H=-272.0kJ?mol-1,②2Al(s)+2/3O2(g)=Al2O3(s)△H=-1675.7kJ?mol-1,将方程式②-①×3得2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ?mol-1;
(2) 标准状况下44.8L氢气物质的量为2mol,燃烧生成液态水时放出571.6KJ的热量,则1mol氢气燃烧生成液态水放热285.8KJ,故氢气的燃烧热为285.8KJ,反应的热化学方程式为:2H2(g)+O2(g)=2H2(l)△=-571.6KJ/mol;1mol液态水变成气态时需要吸收44KJ的热量的热化学方程式为:H2O(l)=H2O(g)△H=+44KJ/mol;①2H2(g)+O2(g)=2H2O(l)△=-571.6KJ/mol;②H2O(l)=H2O(g)△H=+44KJ/mol;由盖斯定律计算得到(①+2×②)/2得到:H2(g)+1/2O2(g)=H2O(g),ΔH=-241.8kJ/mol。
考点:热化学方程式

 阅读快车系列答案
阅读快车系列答案“温室效应”是哥本哈根气候变化大会研究的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决“温室效应”的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有 (填字母)。
A.采用节能技术,减少化石燃料的用量
B.鼓励乘坐公交车出行,倡导低碳生活
C.利用太阳能、风能等新型能源替代化石燃料
(2)一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)=C2H4(g)+3O2(g) △Hl="+1411.0" kJ/mol
2CO2(g)+3H2O(l)=C2H5OH(l)+3O2(g) △H2="+1366.8" kJ/mol
则由乙烯水化制乙醇的热化学方程式是 。
(3)在一定条件下,6H2(g)+2CO2(g) CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
| 温度(K) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
根据上表中数据分析:
①温度一定时,提高氢碳比[
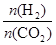 ],CO2的转化率 (填“增大”“减小”或“不变”)。
],CO2的转化率 (填“增大”“减小”或“不变”)。②该反应的正反应为 (填“吸”或“放”)热反应。
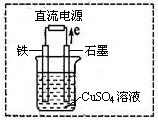
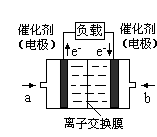
(4)下图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则b处通入的是 (填“乙醇”或“氧气”),a处发生的电极反应是 。
雾霾已经严重影响我们的生存环境。火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。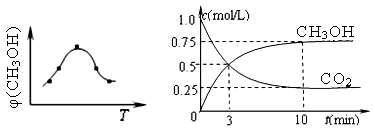
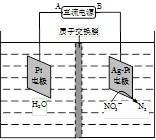
图22-1 图22-2 图22-3
(1)利用甲烷催化还原NOx:
①CH4(g) + 4NO2(g) =" 4NO(g)" + CO2(g) + 2H2O(g) △H1=-574kJ?mol-1
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)将CO2转化为甲醇的热化学方程式为:
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H3
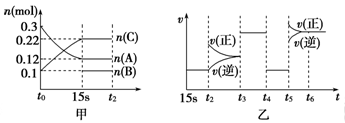
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线(见图22-1),则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”)。
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图22-2所示。
下列说法正确的是 (填字母代号)。
| A.第10min后,向该容器中再充入1molCO2和3molH2,则再次达到平衡时c(CH3OH) ="1.5" mol/L |
| B.达到平衡时,氢气的转化率为0.75 |
| C.0~10分钟内,氢气的平均反应速率为0.075mol/(L?min) |
| D.该温度下,反应的平衡常数的值为3/16 |
(3)某种脱硫工艺中将烟气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程为 。
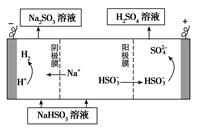
(4)电化学降解NO3- 的原理如题22-3图所示。
①电源正极为 (填“A”或“B”),阴极反应式为 。
②若电解过程中转移了1mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为 g。

 4CO(g) + BaS(s) △H1=+ 571.2 kJ·mol-1 ①
4CO(g) + BaS(s) △H1=+ 571.2 kJ·mol-1 ①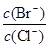 = 时,开始生成第二种沉淀,随着AgNO3溶液的进一步滴加,此时生成的沉淀以 为主,且
= 时,开始生成第二种沉淀,随着AgNO3溶液的进一步滴加,此时生成的沉淀以 为主,且 2CO(g)的△H= kJ·mol-1。
2CO(g)的△H= kJ·mol-1。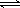 2NH3 △H ="-92.4" kJ/mol,开始他们将N2和H2混合气体20mol (体积比1:1)充入5L合成塔中.反应前压强为P0,反应过程中压强用P表示,反应过程中P/P0与时间t的关系如图所示。请回答下列问题:
2NH3 △H ="-92.4" kJ/mol,开始他们将N2和H2混合气体20mol (体积比1:1)充入5L合成塔中.反应前压强为P0,反应过程中压强用P表示,反应过程中P/P0与时间t的关系如图所示。请回答下列问题: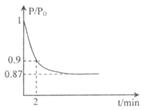
 CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。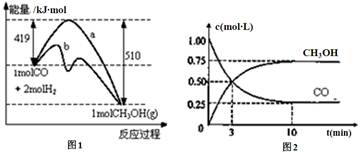
 CH3OH(g)的化学平衡常数为 。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡 移动 (填“正向”、“逆向”或“不”)。
CH3OH(g)的化学平衡常数为 。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡 移动 (填“正向”、“逆向”或“不”)。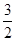 O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1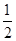 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1 CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1