题目内容
(1)已知下列两个热化学方程式:
C3H8(g)+5O2(g) =3CO2(g)+4H2O(l) ΔH=-2220.0 kJ·mol-1
H2O(l)=H2O(g) ΔH="+44.0" kJ·mol-1
则0.5 mol丙烷燃烧生成CO2和气态水时释放的热量为___________ 。
(2)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如下图所示),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN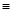 N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
(3)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:
2H2+O2=2H2O,电解质溶液为稀H2SO4溶液,电池放电时是将_________能转化为___________能。其电极反应式分别为:
负极_________________________,正极_____________________________。
(1) 1022kJ (2) 724kJ (3)化学能转化为 电能 负 极2H2-4e-==4H+,正极 O2+4e-+4H+= 2H2O
解析试题分析:(1)利用盖斯定律可以推出C3H8(g)+5O2(g) 3CO2(g)+4H2O(g) ΔH=-2044.0 kJ·mol-1.(2)反应前后能量的变化为生成物键能总和减去反应物键能总和=2*941-4*193=724 (3)原电池是将化学能转变为电能两极反应为负 极2H2-4e-==4H+,正极 O2+4e-+4H+= 2H2O
考点:化学反应过程中的能量变化。

“温室效应”是哥本哈根气候变化大会研究的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决“温室效应”的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有 (填字母)。
A.采用节能技术,减少化石燃料的用量
B.鼓励乘坐公交车出行,倡导低碳生活
C.利用太阳能、风能等新型能源替代化石燃料
(2)一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)=C2H4(g)+3O2(g) △Hl="+1411.0" kJ/mol
2CO2(g)+3H2O(l)=C2H5OH(l)+3O2(g) △H2="+1366.8" kJ/mol
则由乙烯水化制乙醇的热化学方程式是 。
(3)在一定条件下,6H2(g)+2CO2(g) CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
| 温度(K) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
根据上表中数据分析:
①温度一定时,提高氢碳比[
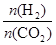 ],CO2的转化率 (填“增大”“减小”或“不变”)。
],CO2的转化率 (填“增大”“减小”或“不变”)。②该反应的正反应为 (填“吸”或“放”)热反应。
(4)下图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则b处通入的是 (填“乙醇”或“氧气”),a处发生的电极反应是 。
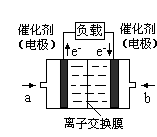
雾霾已经严重影响我们的生存环境。火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。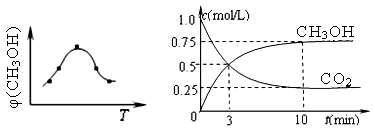
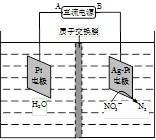
图22-1 图22-2 图22-3
(1)利用甲烷催化还原NOx:
①CH4(g) + 4NO2(g) =" 4NO(g)" + CO2(g) + 2H2O(g) △H1=-574kJ?mol-1
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)将CO2转化为甲醇的热化学方程式为:
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H3
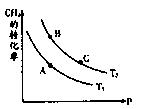
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线(见图22-1),则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”)。
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图22-2所示。
下列说法正确的是 (填字母代号)。
| A.第10min后,向该容器中再充入1molCO2和3molH2,则再次达到平衡时c(CH3OH) ="1.5" mol/L |
| B.达到平衡时,氢气的转化率为0.75 |
| C.0~10分钟内,氢气的平均反应速率为0.075mol/(L?min) |
| D.该温度下,反应的平衡常数的值为3/16 |
(3)某种脱硫工艺中将烟气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程为 。
(4)电化学降解NO3- 的原理如题22-3图所示。
①电源正极为 (填“A”或“B”),阴极反应式为 。
②若电解过程中转移了1mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为 g。
常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为kJ.mol-1)下表是一些键能数据(kJ·mol-1)
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-F | 427 | C-Cl | 330 | C-I | 218 |
| H-H | 436 | S=S | 255 | H-S | 339 |
回答下列问题:
(1)由表中数据规律预测C-Br键的键能范围:_________ <C-Br键能<__________ (回答数值和单位)
(2)热化学方程式2H2(g)+S2(g) =2H2S(g);△H= QkJ·mol-1;则Q=
(3) 已知下列热化学方程式:
O2 (g) = O+2(g) + e—
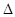 H1=" +1175.7" kJ·mol-1
H1=" +1175.7" kJ·mol-1PtF6(g) + e—= PtF6—(g)
 H2= —771.1 kJ·mol-1
H2= —771.1 kJ·mol-1O2+PtF6—(s) = O2+(g) + PtF6—(g)
 H3=" +482.2" kJ·mol-1
H3=" +482.2" kJ·mol-1则反应O2(g) + (g) = O2+PtF6— (s)
 H="_____________" kJ·mol-1。
H="_____________" kJ·mol-1。 I.已知:反应①H2(g) + Cl2(g) = 2HCl(g) ΔH=" —184" kJ/mol
②4HCl(g)+O2(g)  2Cl2(g)+2H2O(g) ΔH=" —115.6" kJ/mol
2Cl2(g)+2H2O(g) ΔH=" —115.6" kJ/mol 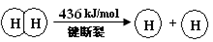
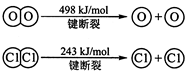
请回答:
(1)H2与O2反应生成气态水的热化学方程式
(2)断开1 mol H—O 键所需能量约为 kJ。
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: 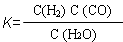 ,它所对应的化学方程式为: 。
,它所对应的化学方程式为: 。
(2)已知在400℃时,N2 (g)+ 3H2(g)  2NH3(g) △H<0 的K="0.5," 则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
2NH3(g) △H<0 的K="0.5," 则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
A.缩小体积增大压强 B.升高温度 C.加催化剂 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:A(g) + 3B(g)  2C(g) + D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
2C(g) + D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
| t/K | 300 | 400 | 500 | … |
| K/(mol·L-1)2 | 4×106 | 8×107 | K1 | … |
请完成下列问题:
①判断该反应的ΔH 0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是 (填序号)。
A.3v(B)(正)=2v(C)(逆) B.A和B的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变

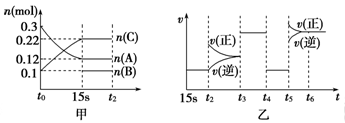
 CO(g)+3H2(g),试回答下列问题。
CO(g)+3H2(g),试回答下列问题。