题目内容
【题目】甲同学进行了FeCl2溶液的配制、浓度的测定以及Fe2+还原性的实验,并针对异常现象进行探究。
步骤一:制取FeCl2甲同学准备用两种方案制取。
方案1:按下图装置用H2还原无水FeCl3制取。
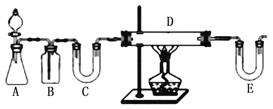
E中盛放的试剂是____________;D中反应的化学方程式为____________。此方案有个明显的缺陷是___________________________。
方案2:由0.1 molL-1 FeCl3溶液制取FeCl2溶液,你认为其操作应该是____________ 。
步骤二:测定方案2所配FeCl2溶液的物质的量浓度。用重铬酸钾法(一种氧化还原滴定法)可达到目的。若需配制浓度为0.01000 mol·L-1的K2Cr2O7标准溶液480 mL,实验中用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少_______________,
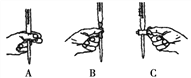
本实验滴定过程中操作滴定管的图示正确的是____________(填编号)。
下列错误的操作使测定的FeCl2 溶液浓度偏小的是______________。
A.若在配制K2Cr2O7标准溶液定容时采取俯视姿势
B.若滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失。
C.锥形瓶洗净后未干燥
步骤三:向2 mL FeCl2溶液中滴加2滴0.1 mol·L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol·L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
甲同学探究“步骤三”中溶液褪色的原因:
实验I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
实验II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀,并测得生成了两种可直接排放到空气中的气体。
实验III.向2 mL 0.1 mol·L-1 FeCl3溶液中滴加2滴0.1 molL-1 KSCN溶液,变红,通入O2,无明显变化。
①实验I说明溶液红色褪去是因为SCN-发生了反应而不是Fe3+发生反应。
②实验III的目的是_____________________。
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-和相关气体。写出该反应的离子方程式_______________________。
【答案】 碱石灰(NaOH或CaO或其它碱性固体干燥剂) H2+2FeCl3=2FeCl2+2HCl 没有处理尾气H2 向0.1 mol·L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液。 500 mL容量瓶、胶头滴管 A A 排除H2O2分解产生的O2氧化SCN-的可能。 2SCN—+ 11H2O2 == 2SO42-+ 2H++2 CO2 ↑+ N2↑+10 H2O
【解析】步骤一:方案1:按如图中装置可知,用H2还原无水FeCl3制取无水FeCl2,A装置一般用锌和稀盐酸制备H2,B装置用来除去氢气中的氯化氢,C装置用来干燥氢气,可以装置碱石灰,E装置中也要装置碱石灰,吸收氯化氢气体同时防止空气中的水份进入D装置,D装置中用氢气与氯化铁反应生成氯化亚铁,所以E中盛放的试剂是 碱石灰,D中反应的化学方程式为 H2+2FeCl3=2FeCl2+2HCl,根据装置图可知,此方案有个明显的缺陷是没有处理尾气H2;
方案2:由FeCl3溶液制取FeCl2溶液,可以在氯化铁溶液中加入足量铁粉,其操作为向0.1 molL-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液;
步骤二:根据配制一定物质的量浓度溶液的操作步骤可知,配制溶液是需要500 mL容量瓶、胶头滴管、量筒、玻璃棒、烧杯等,在操作滴定管时应用左手握住活塞,手指在另上侧拧开活塞,故选 A;在氧化还原滴定中:A.若在配制K2Cr2O7标准溶液定容时采取俯视姿势,会使标准液的浓度偏高,导致消耗的标准液的体积偏小,会使测定的FeCl2溶液浓度偏小,正确;B.若滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,使标准液的体积偏大,会使测定的FeCl2溶液浓度偏大,B错误;C.锥形瓶洗净后未干燥,对实验没有影响,C错误,答案选A;
步骤三:根据实验步骤可知,实验III的目的是排除H2O2分解产生的O2氧化SCN-的可能,在酸性条件下H2O2将SCN-氧化成SO42-和氮气,同时有二氧化碳生成,反应的离子方程式为2SCN-+ 11H2O2=2SO42-+ 2H++2 CO2 ↑+ N2↑+10 H2O。

 寒假学与练系列答案
寒假学与练系列答案