题目内容
【题目】常温下,向10mL0.1mol·L-1的HR溶液中逐渐滴入0.1mol·L-1的NH3·H2O溶液,所得溶液pH及导电能力变化如图。下列分析不正确的是

A. a~b点导电能力增强,说明HR为弱酸
B. b点溶液pH=7,此时酸碱恰好中和
C. b、c两点水的电离程度:b<c
D. c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
【答案】C
【解析】A、加入10mL等浓度的氨水,两者恰好完全反应,HR+NH3·H2O=NH4R+H2O,假设HR为强酸,NH4R是强电解质,反应前后导电能力相同,但a~b图像导电能力增大,因此假设错误,即HR为弱酸,故说法正确;B、根据图像,加入10mLNH3·H2O,此时pH=7,b点导电能力最强,说明此时两者恰好完全反应,故说法正确;C、b点溶质为NH4R,NH4R是弱酸弱碱,发生水解,促进水的电离,c点溶质NH4R、NH3·H2O,此时溶液显碱性,说明NH3·H2O的电离程度大,NH3·H2O是弱碱,对水的电离抑制作用,两点水的电离程度为b>c,故说法错误;D、c点溶质NH4R、NH3·H2O,此时溶液显碱性,说明NH3·H2O的电离程度大,因此c(NH4+)>c(R-),c(OH-)>c(H+),故说法正确。

【题目】亚硫酸盐在工业生产中冇广泛的应用,某同学在实验中对亚硫酸盐的制备和性质进行探究。
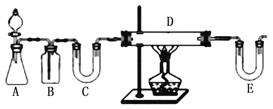
(1)Cu2SO3·CuSO32H2O是一种深红色固体,不溶于水和乙醇,100℃时发生分解,其制备实验装置如图所示。

①仪器X的名称是________。常温下用装置A制取SO2时,用较浓的硫酸而不用稀硫酸,其原因是____________________。
②装置C的作用是________________________。
③装置B中发生反应的离子方程式为_____________________。
④从装置B中获得的固体需先用蒸馏水充分洗涤,再真空干燥,而不直接用烘干的方式得到产品,其原因是_________________________。
(2)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.NaHSO3和NaClO恰好反应;II.NaHSO3过量;III.NaClO过量。甲同学欲通过下列实验确定该反应属于哪一种情况,请完成下表:
实验操作 | 预期现象及结论 |
取上述反应后的混合溶液于试管 A中,滴加稀硫酸 | 若有气泡产生,则_①__(填“I”“II”或“III”,下同)成立,若没有气泡产生,则_②___成立 |
另取上述反应后的混合溶液于试管B中,滴加几滴淀粉KI溶液, 充分振荡 | ③___,则III成立 |
(3)请设计简单实验方案比较室温下NaHSO3浓液中HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小:________________________。