题目内容
【题目】C、O、Na、Cl、Fe、Cu是元素周期表前四周期中的常见元素。
(1)Fe在元素周期表中的位置是_____,Cu基态原子核外电子排布式为________。
(2)C和O的气态氢化物中,较稳定的是________(写化学式)。C的电负性比Cl的________(填“大”或“小”)。
(3)写出Na2O2与CO2反应的化学方程式____________________________。
(4)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
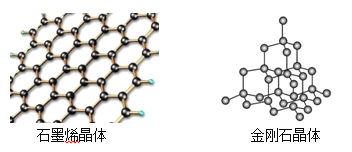
①在石墨烯晶体中,每个C原子连接___________个六元环,每个六元环占有___________个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接__________个六元环,六元环中最多有_________个C原子在同一平面。
(5)刻蚀印刷电路的废液中含有大量的CuCl2、FeCl2、FeCl3,任意排放将导致环境污染和资源的浪费,为了使FeCl3循环利用和回收CuCl2,回收过程如下:
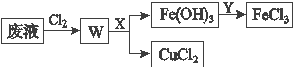
①试剂X的化学式为______________;
②若常温下1 L废液中含CuCl2、FeCl2、FeCl3的物质的量浓度均为0.5 mol·L-1,则加入Cl2和物质X后,过滤。为使溶液铁元素完全转化为Fe(OH)3,而CuCl2 不产生沉淀。则应控制pH的范围是____________________________(设溶液体积保持不变),已知:Ksp[Fe(OH)3]=1.0×10-38、Ksp[Cu(OH)2]=2.0×10-20、lg5=0.7。
【答案】第四周期第Ⅷ族 1s22s22p63s23p63d104s1 H2O 小 2Na2O2+2CO2=2Na2CO3+O2 3 2 12 4 CuO 3~4.3
【解析】
(1)Fe是26号元素,核外电子排布为1s22s22p63s23p63d64s2,因此在元素周期表中的位置是第四周期第Ⅷ族;Cu是29号元素,其基态原子核外电子排布式为1s22s22p63s23p63d104s1;故答案为:第四周期第Ⅷ族;1s22s22p63s23p63d104s1。
(2)同周期,非金属性越强,其气态氢化物越稳定,因此较稳定的是H2O;Cl非金属性强,其电负性越大,因此C的电负性比Cl的小;故答案为:H2O;小。
(3)Na2O2与CO2反应生成碳酸钠和氧气,其化学方程式为2Na2O2+2CO2=2Na2CO3+O2;故答案为:2Na2O2+2CO2=2Na2CO3+O2。
(4)①根据均摊法计算,在石墨烯晶体中,每个C原子被3个六元环共有,每个六元环占有的碳原子数6×![]() =2,所以,每个六元环占有2个C原子;故答案为:3;2。
=2,所以,每个六元环占有2个C原子;故答案为:3;2。
②在金刚石的晶体结构中每个碳原子与周围的4个碳原子形成四个碳碳单键,最小的环为6元环,每个单键为3个环共有,则每个C原子连接4×3=12个六元环,六元环为椅式结构,六元环中有两条边平衡,连接的4个原子处于同一平面内,如图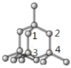 ;故答案为:12;4。
;故答案为:12;4。
(5)①W中含有CuCl2、FeCl3,加入X使铁离子转化为氢氧化铁沉淀,加入的X由于调节溶液pH值,且不引入杂质,X为CuO等;故答案为:CuO。
②常温下1 L废液中含CuCl2、FeCl2、FeCl3的物质的量浓度均为0.5 mol·L-1,则加入Cl2后溶液中FeCl2转变为FeCl3,因此c(FeCl3)=1 molL1,铜离子开始沉淀时,![]() ,
,![]() ,
,![]() ,pH = 4.3,铁离子沉淀完全时,
,pH = 4.3,铁离子沉淀完全时,![]() ,
,![]() ,
,![]() ,pH =3,故溶液pH应控制在3.0~4.3之间;故答案为:3.0~4.3。
,pH =3,故溶液pH应控制在3.0~4.3之间;故答案为:3.0~4.3。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案