题目内容
【题目】过氧化钙在工农业生产中有广泛的用途。
Ⅰ.过氧化钙制备方法很多。
(1)制备方法一:H2O2溶液与过量的Ca(OH)2悬浊液反应可制备CaO2·8H2O,其化学方程式为______________________________________________________________。
(2)制备方法二:利用反应Ca(s)+O2![]() CaO2(s),在纯氧条件下制取CaO2,实验室模拟装置示意图如下:
CaO2(s),在纯氧条件下制取CaO2,实验室模拟装置示意图如下:
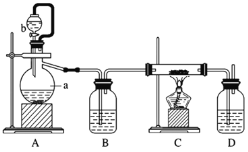
请回答下列问题:
①装置A中反应的化学方程式为________________,仪器a的名称为 ___________。
②装置D中盛有的液体是浓硫酸,其作用一是_________;二是_____________。
Ⅱ.水产运输中常向水中加一定量CaO2·8H2O增加溶氧量(DO),水中溶氧量(DO)是用每升水中溶解氧气的质量来表示,其测定步骤及原理为:
a.固氧:碱性下,O2将Mn2+氧化为MnO(OH)2:2Mn2++O2+4OH=2MnO(OH)2↓;
b.氧化:酸性下,MnO(OH)2将I氧化为I2:MnO(OH)2+2I+4H+=Mn2++I2+3H2O;
c.滴定:用Na2S2O3标准溶液滴定生成的I2:2S2O32-+I2=S4O62-+2I。
某同学向水中加一定量CaO2·8H2O,取此水样100.00mL,按上述方法测定水中溶氧量(DO),消耗0.0100mol·L1 Na2S2O3标准溶液13.50mL。
(1)滴定过程中使用的指示剂是_______________________________;
(2)该水样中的溶解氧量(DO)为__________________mg·L1。
(3)步骤b中加入硫酸溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因________________________(用离子方程式表示,至少写出2个)。
【答案】Ca(OH)2+H2O2+6H2O=CaO2·8H2O 2H2O2![]() 2H2O+O2↑ 蒸馏烧瓶 观察氧气流速,判断氧气通入是否过快及氧气与钙反应进行的程度 防止空气CO2和水蒸气进入装置C影响产品纯度 淀粉溶液 10.80mg·L1 2H++S2O32-=S↓+SO2↑+H2O、SO2+I2+2H2O=4H++SO42-+2I-、4H++4I-+O2=2I2+2H2O
2H2O+O2↑ 蒸馏烧瓶 观察氧气流速,判断氧气通入是否过快及氧气与钙反应进行的程度 防止空气CO2和水蒸气进入装置C影响产品纯度 淀粉溶液 10.80mg·L1 2H++S2O32-=S↓+SO2↑+H2O、SO2+I2+2H2O=4H++SO42-+2I-、4H++4I-+O2=2I2+2H2O
【解析】
Ⅰ.(1)H2O2溶液与过量的Ca(OH)2悬浊液反应可制备CaO28H2O,反应为Ca(OH)2+H2O2+6H2O=CaO28H2O;故答案为:Ca(OH)2+H2O2+6H2O=CaO28H2O。
(2)装置A中反应的化学方程式为2H2O2![]() 2H2O+O2↑,仪器a为蒸馏烧瓶;装置D中盛有的液体是浓硫酸,其作用一是观察氧气的流速,判断氧气通入是否过快及氧气与钙反应进行的程度;二是防止空气CO2和水蒸气进入装置C影响产品纯度;故答案为:2H2O2
2H2O+O2↑,仪器a为蒸馏烧瓶;装置D中盛有的液体是浓硫酸,其作用一是观察氧气的流速,判断氧气通入是否过快及氧气与钙反应进行的程度;二是防止空气CO2和水蒸气进入装置C影响产品纯度;故答案为:2H2O2![]() 2H2O+O2↑;蒸馏烧瓶;观察氧气流速,判断氧气通入是否过快及氧气与钙反应进行的程度;防止空气CO2和水蒸气进入装置C影响产品纯度。
2H2O+O2↑;蒸馏烧瓶;观察氧气流速,判断氧气通入是否过快及氧气与钙反应进行的程度;防止空气CO2和水蒸气进入装置C影响产品纯度。
Ⅱ.(1)根据2S2O32+I2=S4O62+2I-,可选指示剂为淀粉溶液;故答案为:淀粉溶液。
(2)根据方程式可得关系式O2~4S2O32,则100.0mL水样中n(O2) =![]() n(S2O32)=
n(S2O32)=![]() ×0.0100molL1×0.0135L =
×0.0100molL1×0.0135L =![]() ×106mol,该水样中的溶解氧量(DO)为
×106mol,该水样中的溶解氧量(DO)为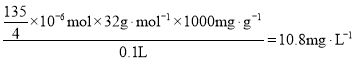 ;故答案为:10.8。
;故答案为:10.8。
(3)步骤b中加入硫酸溶液反应后,若溶液pH过低,溶液中含有大量氢离子,氢离子会和硫代硫酸根反应生成硫沉淀和二氧化硫,二氧化硫和单质碘反应,碘离子还可能在氢离子条件下被氧气氧化,因此发生的离子方程式表示为2H++S2O32-= S↓+SO2↑+H2O、SO2+I2+2H2O=4H++SO42-+2I-、4H++4I- +O2=2I2+2H2O;故答案为:2H++S2O32-= S↓+SO2↑+H2O、SO2+I2+2H2O=4H++SO42-+2I-、4H++4I- +O2=2I2+2H2O(任写两个)。