题目内容
【题目】微量元素硼对植物生长及人体健康有着十分重要的作用,也广泛应用于新型材料的制备。
(1)基态硼原子的价电子轨道表达式是_______________。与硼处于同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为___________。
(2)晶体硼单质的基本结构单元为正二十面体,其能自发地呈现多面体外形,这种性质称为晶体的________。
(3)B的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
①B2H6分子结构如图,则B原子的杂化方式为________。

②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是______,写出一种与氨硼烷互为等电子体的分子_____(填化学式)。
(4)以硼酸(H3BO3)为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂。BH![]() 的键角是________,立体构型为___________。
的键角是________,立体构型为___________。
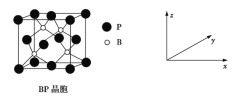
(5)磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是_______;已知晶胞边长为458 pm,则磷化硼晶体的密度是____g·cm-3(列式并计算,结果保留两位有效数字,已知4.583=96.07)。
【答案】![]() C>Be>B 自范性 sp3杂化 N C2H6 109°28' 正四面体 正方形
C>Be>B 自范性 sp3杂化 N C2H6 109°28' 正四面体 正方形 ![]() =2.9
=2.9
【解析】
(1)硼为5号元素,其核外电子排布式为1s22s22p1,价电子轨道表达式为![]() ;与硼处于同周期且相邻的两种元素为Be和C,同周期元素从左到右,第一电离能呈增大趋势,但Be的2s轨道全充满,处于稳定状态,所以第一电离能大小顺序为B<Be<C;
;与硼处于同周期且相邻的两种元素为Be和C,同周期元素从左到右,第一电离能呈增大趋势,但Be的2s轨道全充满,处于稳定状态,所以第一电离能大小顺序为B<Be<C;
(2)晶体的自范性是晶体中的粒子在微观空间里呈现周期性有序排列的宏观表象,即晶体能自发地呈现多面体外形的性质;
(3)①由题图可以看出,每个B结合4个H,B上不存在孤对电子,所以B的价层电子对数为4,采用sp3杂化;
②NH3BH3中N提供孤对电子,B提供空轨道,从而形成配位键;与NH3BH3互为等电子体的分子为C2H6;
(4)![]() 的成键电子对为4,孤电子对为0,故其空间构型为正四面体形,键角为109°28';
的成键电子对为4,孤电子对为0,故其空间构型为正四面体形,键角为109°28';
(5)BP晶胞沿z轴在平面投影,B原子构成的几何形状为正方形;BP晶胞中有4个B原子和4个P原子,磷化硼晶体的密度为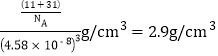 。
。

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
