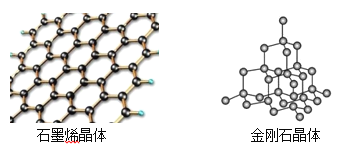
��Ŀ����
����Ŀ���Ҵ�����Ϊ21���͵�����ɫ��Դ��������ú�����Ṥ�ճ��졢�ɱ�����������������Ҵ��нϴ�ļ۸���˿�չ����������Ҵ��Ĵ���Ӧ�о�������Ҫ���塣�ش���������:
��1������������Ҵ���һ�����ӵķ�Ӧ��ϵ����ͬ�ķ�Ӧ�����ᵼ���γɲ�ͬ�IJ�Ʒ�ֲ�����Ҫ��Ӧ��������:
��Ӧ��CH3COOH(g) + H2(g)��CH3CHO(g) +H2O(g) H1
��Ӧ��CH3CHO(g) +H2(g) ��CH3CH2OH(g) ��H2
���ָ���Ӧ����:
��Ӧ��CH3CH2OH(g) + CH3COOH(g)��CH3COOCH2CH3(g) +H2O(g) H3
��Ӧ��CH3COOCH2CH3(g) +2H2(g) ��2CH3CH2OH(g) H4
H4=___ (��H1����H2�� H3��ʾ)��
��2������������Ҵ��ķ�Ӧ�ɱ�ʾΪCH3COOH(g) + 2H2(g)==CH3CH2OH(g) + H2O(g) H<0������߸÷�Ӧ�������ƽ��ת���ʣ��ɲ�ȡ��������ʩ��_________���������������������( ����Ӧ)�Ļ�ѧ����ʽ�ɱ�ʾΪ____________.
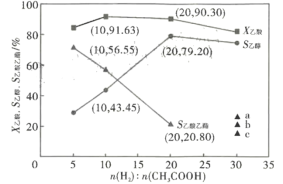
��3���ں���2609��C�� ��ѹ1.4MPa, ԭ������һ��������ͨ��ij������������������Ҵ��ȷ�Ӧ����/��(���ʵ���)Ͷ�ϱȶԷ�Ӧ��Ӱ����ͼ��ʾ��X������ʾ�����ת����, S�Ҵ���S���������ֱ��ʾ�Ҵ�������������ѡ���ԣ����У�S�Ҵ�=![]() ��S��������=
��S��������=![]() ������ͼ�����ݷ����������/��Ͷ�ϱ�ֵ��_______________,�������£�������Ӧ��____________(������������������)���е��ף�������____________ ;����ͼ�����߱仯���ɣ��ж���/��Ͷ�ϱ�=30ʱ��S�����������������������ͼ��a��b��c�е�______��;��/��Ͷ�ϱ�=20ʱ������H2��ת����=_______. ( �г�����ʽ���ɣ���ͬ),�Ҵ��ķ�ѹP�Ҵ�=__________(��ѹ=��ѹ�����ʵ�������)��
������ͼ�����ݷ����������/��Ͷ�ϱ�ֵ��_______________,�������£�������Ӧ��____________(������������������)���е��ף�������____________ ;����ͼ�����߱仯���ɣ��ж���/��Ͷ�ϱ�=30ʱ��S�����������������������ͼ��a��b��c�е�______��;��/��Ͷ�ϱ�=20ʱ������H2��ת����=_______. ( �г�����ʽ���ɣ���ͬ),�Ҵ��ķ�ѹP�Ҵ�=__________(��ѹ=��ѹ�����ʵ�������)��
���𰸡�H1+H2-H3 �����¶ȡ�����ѹǿ������������Ũ�ȡ���С����Ũ�� 2CH3COOH(g) + 2H2(g) ��CH3COOCH2CH3(g) +2H2O(g) 20 �� �Ҵ�������������ѡ����֮��Ϊ100%��˵������ȩ���ɣ�����Ӧ���ܽ��е��� a 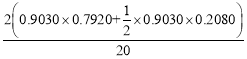 ��100%
��100% 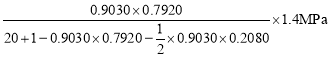
��������
(1)���ݸ�˹���ɣ���Ӧ��+��-�۵÷�Ӧ�ܣ�����H4=H1+H2-H3��
(2)�÷�ӦH<0��Ϊ���ȷ�Ӧ�����Խ����¶ȿ�ʹƽ���������������ת���ʣ���������������Ҳ����ʹƽ������ͬʱ���������ת���ʣ��÷�ӦΪѹǿ��С�ķ�Ӧ���Լ�ѹ����ʹƽ���������������ת���ʣ���ʱ�������������ʹƽ�����ƣ����������ת���ʣ������������������ת���ʿ��ԣ������¶ȡ�����ѹǿ������������Ũ�ȡ���С����Ũ�ȣ��������������Ӧ�����Ҵ����Ҵ������ᷴӦ�������������������ܵķ�Ӧ����ʽΪ��2CH3COOH(g) + 2H2(g) ��CH3COOCH2CH3(g) +2H2O(g)��
(3)�÷�Ӧ��Ŀ������ȡ�Ҵ�����ͼ��֪����/��Ͷ�ϱ�ֵ��20ʱ�������ת���ʽϸߣ�ͬʱ�Ҵ���ѡ���Խϴ�
��ͼ��֪��Ͷ�ϱ�������Ҵ�������������ѡ����֮��Ϊ100%��˵������ȩ���ɣ�����Ӧ���ܽ��е��ף�
Ͷ�ϱ���20��Ϊ30ʱ��S�Ҵ���С������Ӧ��������ֻ���Ҵ�����������������������ѡ�����½���������������ѡ����Ӧ����������Ӧ������a�㣻
Ͷ�ϱ�Ϊ20�������ʼͶ��Ϊ��20mol������1mol���ᣬ��ʱ�����ת��Ϊ90.30%������Ӧ����0.9030mol�������ɵ��Ҵ������ʵ���Ϊn�Ҵ�=n������S�Ҵ�=0.9030��0.7920mol�����ɵ��������������ʵ���n��������=n������![]() S��������=
S��������=![]() ��0.9030��0.2080mol�����ݷ�����������Ӧ��
��0.9030��0.2080mol�����ݷ�����������Ӧ��
(��)CH3COOH(g) + 2H2(g)![]() CH3CH2OH(g) + H2O(g)
CH3CH2OH(g) + H2O(g)
(��)2CH3COOH(g) + 2H2(g) ��CH3COOCH2CH3(g) +2H2O(g)
��֪�����ĵ����������ʵ���Ϊ2(n��������+n�Ҵ�)=2(0.9030��0.7920mol+![]() ��0.9030��0.2080mol)����ת����Ϊ
��0.9030��0.2080mol)����ת����Ϊ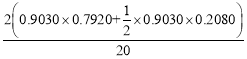 ��100%��
��100%��
����������Ӧ��Ϊ�������ʵ�����С�ķ�Ӧ���ɷ���ʽ��֪n��=n�Ҵ�=0.9030��0.7920mol��n��=n��������=![]() ��0.9030��0.2080mol����Ӧ�������ܵ����ʵ���Ϊn��=(20+1-0.9030��0.7920-
��0.9030��0.2080mol����Ӧ�������ܵ����ʵ���Ϊn��=(20+1-0.9030��0.7920-![]() ��0.9030��0.2080)mol�����ݷ�ѹ=��ѹ�����ʵ���������֪p�Ҵ�=p����
��0.9030��0.2080)mol�����ݷ�ѹ=��ѹ�����ʵ���������֪p�Ҵ�=p����![]() =
=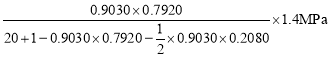 ��
��