题目内容
3.环己基甲酸是一种无色或浅黄色油状液体,环己基甲酸及其衍生物是重要的有机化工原料和合成药物的中间体,在新材料和药物研发中具有广泛的价值.其合成方法如下: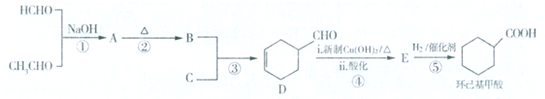
其中链烃C的相对分子质量在50~70之间,碳氢原子个数比为2:3,核磁共振氢谱显示有两个峰且面积比为2:l.回答下列问题:
已知:(1)R1CH2CHO+R2CH2CHO$\stackrel{NaOH}{→}$
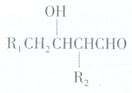 或
或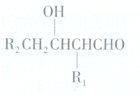
(2)
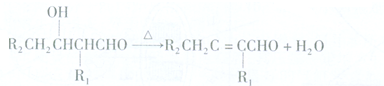
(1)C的结构简式为CH2=CHCH=CH2,其化学名称为1,3-丁二烯.
(2)A的结构简式为HOCH2CH2CHO.
(3)写出下列反应的反应类型:②消去反应;⑤加成反应.
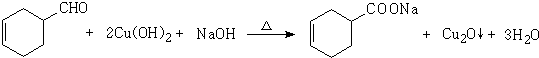
(4)写出D与新制Cu(OH)2反应的化学方程式
 .
.(5)若反应④、⑤的顺序交换是否可行否 (填“是”或“否”),原因是先反应反应⑤,醛基会被氢气还原为羟基.
(6)符合下列条件的环己基甲酸的同分异构体有5种.
①含有六元碳环 ②能发生银镜反应 ③不考虑立体异构.
分析 甲醛与乙醛发生信息(1)中加成反应生成A为HOCH2CH2CHO,A发生信息(2)中的消去反应生成B为CH2=CHCHO.链烃C的相对分子质量在50~70之间,碳氢原子个数比为2:3,设其分子式为(C2H3)n,则50<29n<70,则n=2,故分子式为C4H6,核磁共振氢谱显示有两个峰且面积比为2:l,则C为CH2=CHCH=CH2.B、C发生加成反应得到D,D与新制氢氧化铜发生氧化反应、酸化得到E为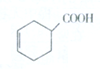 ,E与氢气发生加成反应得到环己基甲酸,据此解答.
,E与氢气发生加成反应得到环己基甲酸,据此解答.
解答 解:甲醛与乙醛发生信息(1)中加成反应生成A为HOCH2CH2CHO,A发生信息(2)中的消去反应生成B为CH2=CHCHO.链烃C的相对分子质量在50~70之间,碳氢原子个数比为2:3,设其分子式为(C2H3)n,则50<29n<70,则n=2,故分子式为C4H6,核磁共振氢谱显示有两个峰且面积比为2:l,则C为CH2=CHCH=CH2.B、C发生加成反应得到D,D与新制氢氧化铜发生氧化反应、酸化得到E为 ,E与氢气发生加成反应得到环己基甲酸.
,E与氢气发生加成反应得到环己基甲酸.
(1)由上述分析可知,C的结构简式为CH2=CHCH=CH2,其化学名称为:1,3-丁二烯,
故答案为:CH2=CHCH=CH2;1,3-丁二烯;
(2)由上述分析可知,A的结构简式为HOCH2CH2CHO,
故答案为:HOCH2CH2CHO;
(3)反应②属于消去反应,反应⑤属于加成反应,
故答案为:消去反应;加成反应;
(4)D与新制Cu(OH)2反应的化学方程式为: ,
,
故答案为: ;
;
(5)先反应反应⑤,醛基会被氢气还原为羟基,反应④⑤不能交换,
故答案为:否;先反应反应⑤,醛基会被氢气还原为羟基;
(6)符合下列条件的环己基甲酸的同分异构体:①含有六元碳环,②能发生银镜反应,含有醛基,支链可以为-OOCH,或者为-OH、-CHO,有同、邻、间、对四种种,不考虑立体异构,共有5种,
故答案为:5.
点评 本题考查有机物的推断,需要学生对给予的信息进行利用,再结合有机物结构、反应条件进行分析解答,(6)中同分异构体为易错点,容易受苯环影响,忽略醛基与羟基处于同一碳原子.

| A. | M与X形成的化合物对应的水化物一定是强酸 | |
| B. | Y2X和Y2X2中化学键类型完全相同 | |
| C. | X、Y的简单离子半径:r(X2-)>r(Y+) | |
| D. | M的气态氢化物比N的气态氢化物稳定 |
| A. | 接触法制硫酸 | B. | 联合法制纯碱 | ||
| C. | 铁矿石炼铁 | D. | 石油的裂化和裂解 |
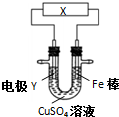
| A. | 若X为直流电源,Y为铜棒接正极,则Fe棒上镀铜 | |
| B. | 若X为直流电源,Y为碳棒接负极,则Fe棒被保护 | |
| C. | 若X为电流计,Y为锌棒,则SO42- 移向Fe棒 | |
| D. | 若X为导线,Y为铜棒,则Fe棒发生还原反应 |
| A. | 25℃和l00℃时H2O的KW | |
| B. | 同温同浓度的KHCO3溶液和NH4HCO3,溶液中的c(HCO3-) | |
| C. | 同温同浓度的NaHCO3溶液和CH3COONa溶液的pH | |
| D. | 中和25mL0.1mol/L NaOH溶液所需CH3COOH和HCl的物质的量 |
| A. |  光合作用 | B. |  烧炭取暖 | C. |  风力发电 | D. |  电解冶炼 |
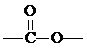 ”的同分异构体有( )
”的同分异构体有( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 8种 |
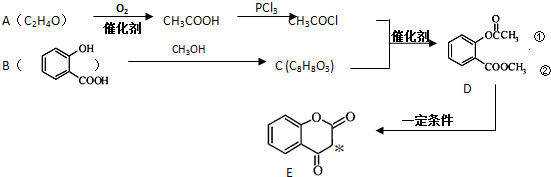
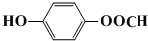 .
.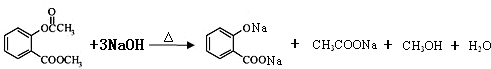 .
.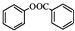 ),根据题目信息设计合成线路,请写出最后一步反应的化学方程式:
),根据题目信息设计合成线路,请写出最后一步反应的化学方程式: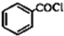 +
+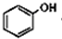 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$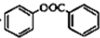 +HCl.
+HCl.