题目内容
【题目】(1)根据下列热化学方程式:
①C(s)+O2(g)===CO2(g) ΔH= - 393.5 kJ·mol-1
②H2(g)+![]() O2(g)===H2O(l) ΔH= - 285.8 kJ·mol-1
O2(g)===H2O(l) ΔH= - 285.8 kJ·mol-1
③CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH= - 870.3 kJ·mol-1
可以计算出2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为_____________
(2)已知在101 kPa时,CO的燃烧热为283 kJ·mol-1。相同条件下,若2 mol CH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,CH4完全燃烧的热化学方程式是______________。
(3)在25 ℃、101 kPa时,1.00 g C6H6(l)燃烧生成CO2(g)和H2O(l),放出41.8 kJ的热量,C6H6的燃烧热ΔH=________kJ·mol,该反应的热化学方程式为______________。
【答案】-488.3 kJ·mol-1 CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H=-891.45kJ/mol -3260.4 C6H6(l)+![]() O2(g)=6CO2(g)+3H2O(l) △H=-3260.4kJ/mol。
O2(g)=6CO2(g)+3H2O(l) △H=-3260.4kJ/mol。
【解析】
(1)已知:①C(s)+O2(g)===CO2(g) ΔH= - 393.5 kJ·mol-1 ,②H2(g)+![]() O2(g)===H2O(l) ΔH= - 285.8 kJ·mol-1,③CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH= - 870.3 kJ·mol-1,依据盖斯定律①×2+②×2-③得到2C(s)+2H2(g)+O2(g)===CH3COOH(l),ΔH=(-393.5 kJ·mol-1) ×2+(-285.8 kJ·mol-1) ×2-(- 870.3 kJ·mol-1)=(-1358.6 kJ·mol-1)+ 870.3 kJ·mol-1=-488.3 kJ·mol-1;答案为-488.3 kJ·mol-1。
O2(g)===H2O(l) ΔH= - 285.8 kJ·mol-1,③CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH= - 870.3 kJ·mol-1,依据盖斯定律①×2+②×2-③得到2C(s)+2H2(g)+O2(g)===CH3COOH(l),ΔH=(-393.5 kJ·mol-1) ×2+(-285.8 kJ·mol-1) ×2-(- 870.3 kJ·mol-1)=(-1358.6 kJ·mol-1)+ 870.3 kJ·mol-1=-488.3 kJ·mol-1;答案为-488.3 kJ·mol-1。
(2)CO的燃烧热为283kJ/mol,相同条件下,2molCH4完全燃烧生成液态水,所放出的热量为283kJ/mol×6.3=1782.9kJ,则1molCH4完全燃烧生成液态水,放出的热量为![]() =891.45kJ,故甲烷完全燃烧生成液态水的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(1)△H=-891.45kJ/mol;答案为CH4(g)+2O2(g)=CO2(g)+2H2O(1)△H=-891.45kJ/mol。
=891.45kJ,故甲烷完全燃烧生成液态水的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(1)△H=-891.45kJ/mol;答案为CH4(g)+2O2(g)=CO2(g)+2H2O(1)△H=-891.45kJ/mol。
(3)1.00gC6H6(l)在O2中完全燃烧生成CO2(g)和H2O(l),放出41.8kJ的热量,则1molC6H6(l)在氧气中完全燃烧放出的热量为41.8×78=3260.4kJ,因此C6H6(l)的燃烧热△H=-3260.4kJ/mol,C6H6(l)燃烧的热化学方程式为C6H6(l)+![]() O2(g)=6CO2(g)+3H2O(l)△H=-3260.4kJ/mol;答案为:-3260.4;C6H6(l)+
O2(g)=6CO2(g)+3H2O(l)△H=-3260.4kJ/mol;答案为:-3260.4;C6H6(l)+![]() O2(g)=6CO2(g)+3H2O(l) △H=-3260.4kJ/mol。
O2(g)=6CO2(g)+3H2O(l) △H=-3260.4kJ/mol。

【题目】实验小组为验证NO2与水反应的产物,用如图所示装置进行实验(夹持装置已略去,气密性已检验)。
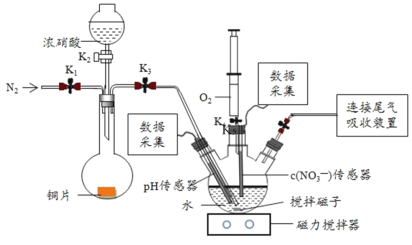
(实验过程)
实验步骤 | 实验现象 |
Ⅰ.打开K1、K3、K5,关闭K2、K4,通入 一段时间N2,关闭K1 | _________ |
Ⅱ.打开K2,放入足量浓HNO3,同时打开pH传感器和NO3―传感器,记录数据 | 圆底烧瓶中反应剧烈,铜片逐渐溶解,溶液变为蓝绿色,_________;片刻后,三颈瓶内的导管口有气泡冒出 |
III.5min后,打开K4,用注射器将少量氧气注入三颈瓶,关闭K4 | 三颈瓶内的气体从无色变为浅红棕色 |
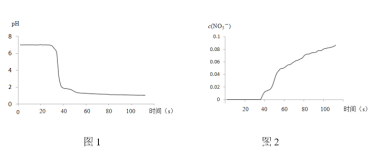
步骤II中,传感器记录数据如图所示:
(解释及结论)
(1)NO2与水反应的离子方程式为____________ 。
(2)步骤I中,通入N2的目的是____________。
(3)将步骤II中圆底烧瓶内的实验现象补充完整:____________。
(4)该实验验证NO2与水反应产物的实验证据包括____________(填序号)。
A.圆底烧瓶中溶液变为蓝绿色
B.三颈瓶内的气体从无色变为浅红棕色
C.pH传感器记录所得数据
D.![]() 传感器记录所得数据
传感器记录所得数据
(5)有同学认为该实验不严谨,因为也可能导致传感器所记录的数据结果____________
【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 H2SO4溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 H2SO4溶液
(1)若配制250 mL H2SO4溶液,则需量筒量取密度为1.84 g·cm-3,质量分数为98%的浓硫酸____mL。
Ⅱ.测定稀硫酸和稀氢氧化钠反应的中和热的实验装置如图所示:
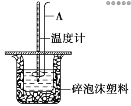
(2)仪器A的名称为___________。
(3)写出表示该反应中和热的热化学方程式:__________________。
(4)取50 mL NaOH溶液和30 mL H2SO4溶液进行实验,实验数据如下表。
实验 次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.6 | 26.6 | 26.6 | 29.1 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①温度差的平均值为____
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 H2SO4溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·(g·℃)-1。则测得的中和热ΔH=___________(取小数点后一位)。
③上述结果与57.3 kJ·mol-1有偏差,产生此偏差的原因可能是____(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.一次性把NaOH溶液倒入盛有H2SO4溶液的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)碎泡沫塑料的作用是___________。
【题目】化工发展是我国能源安全的重要保证。近年来,我国煤化工技术获得重大突破,利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇(CH3OH)是其中的一个研究项目。该研究发生的主要反应如下:
Ⅰ.CO与H2反应合成甲醇
Ⅱ.CO2与H2反应合成甲醇 CO2(g)+3H2(g)CH3OH(g)+H2O(g)
(1)上述反应Ⅰ是原子经济性反应,写出化学反应方程式___________。
(2)在工业上,为了提高上述反应Ⅱ的反应速率,除了采用合适的催化剂之外,还可以采取的措施是_______(填一项即可)。
(3)一定温度下,在容积固定的密闭容器中发生反应Ⅱ,下列可以表明反应达到化学平衡状态的是_____。
a.单位时间消耗nmolCO2的同时,消耗3n mol的H2
b.容器内CH3OH的浓度不再改变
c.容器内气体压强不再改变
d.容器内气体密度不再改变
(4)生成1mol CH3OH放出 a kJ的能量,反应Ⅰ中拆开1mol化学键所需的能量(E)的相关数据如下:
化学键 | H—H | C—O | CO中的 C | H—O | C—H |
E(kJ) | m | n | E1 | x | y |
根据相关数据计算拆开1molC![]() O所需的能量E1=______________kJ。
O所需的能量E1=______________kJ。
(5) H2还原CO2电化学法制备甲醇的工作原理如下图所示: ![]()
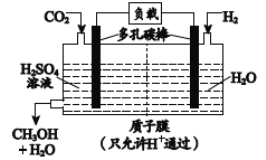
通入H2 的一端是电池的________极(填“正”或“负”),通入CO2的一端发生的电极反应式为_______。