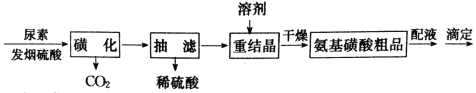
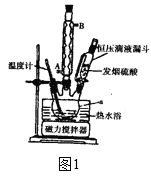
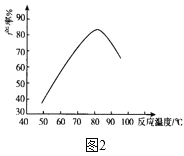
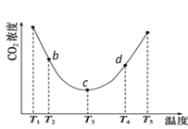
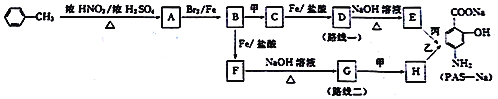
题目内容
【题目】对于反应3X(g)+Y(g)![]() Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
(1)升高温度:____________; (2)增大压强:____________;
(3)增大容器容积:____________; (4)加入X:______________;
(5)加入Y:______________; (6)压缩体积:______________;
(7)加入催化剂_____________。
【答案】增大 增大 减小 增大 增大 增大 增大
【解析】
影响化学反应速率的因素有温度、浓度、压强、催化剂等,从改变外界条件对活化分子的浓度或百分数的影响角度分析化学反应速率的变化。
(1)升高温度,活化分子的百分数增大,单位体积活化分子数增大,反应速率增大;
(2)压强增大,反应物的浓度增大,活化分子浓度增大,单位体积活化分子数增大,反应速率增大;
(3)增大容器容积,反应物的浓度减小,活化分子浓度减小,单位体积活化分子数减小,反应速率减小;
(4)由于X为气体,加入X,使反应物气体浓度增大,活化分子浓度增大,单位体积活化分子数增大,反应速率增大;
(5)由于Y为气体,加入Y气体使反应物的浓度增大,活化分子浓度增大,单位体积活化分子数增大,反应速率增大;
(6)压缩体积,反应物的浓度增大,活化分子浓度增大,单位体积活化分子数增大,反应速率增大;
(7)加入催化剂,活化分子百分数增大,单位体积内活化分子数增大,反应速率增大。

【题目】实验小组为验证NO2与水反应的产物,用如图所示装置进行实验(夹持装置已略去,气密性已检验)。
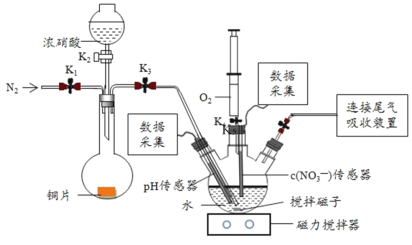
(实验过程)
实验步骤 | 实验现象 |
Ⅰ.打开K1、K3、K5,关闭K2、K4,通入 一段时间N2,关闭K1 | _________ |
Ⅱ.打开K2,放入足量浓HNO3,同时打开pH传感器和NO3―传感器,记录数据 | 圆底烧瓶中反应剧烈,铜片逐渐溶解,溶液变为蓝绿色,_________;片刻后,三颈瓶内的导管口有气泡冒出 |
III.5min后,打开K4,用注射器将少量氧气注入三颈瓶,关闭K4 | 三颈瓶内的气体从无色变为浅红棕色 |
步骤II中,传感器记录数据如图所示:
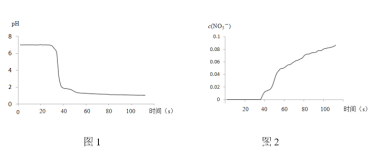
(解释及结论)
(1)NO2与水反应的离子方程式为____________ 。
(2)步骤I中,通入N2的目的是____________。
(3)将步骤II中圆底烧瓶内的实验现象补充完整:____________。
(4)该实验验证NO2与水反应产物的实验证据包括____________(填序号)。
A.圆底烧瓶中溶液变为蓝绿色
B.三颈瓶内的气体从无色变为浅红棕色
C.pH传感器记录所得数据
D.![]() 传感器记录所得数据
传感器记录所得数据
(5)有同学认为该实验不严谨,因为也可能导致传感器所记录的数据结果____________