题目内容
【题目】目前,处理锌矿进行综合利用,多采用传统的“高氧酸浸法”,但该法也存在一些缺点。最近,有文献报道:用高铁闪锌矿(含有ZnS、FeS、CuS、CdS及少量SiO2等)为原料,采用“高氧催化氧化氨浸法”可以联合制取Cu2O(红色)、CdS(黄色)、锌钡白(白色)三种颜料,其流程如图:
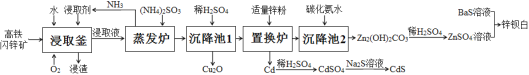
已知:
Ⅰ:浸取剂由碳酸铵、氨水、双氧水等组成;
Ⅱ:浸渣为S、Fe(OH)CO3、SiO2等不溶性物质;
Ⅲ:浸取液中含有[Zn(NH3)4]2+、[Cu(NH3)4]2+、[Cd(NH3)4]2+;
Ⅳ:Cu+在溶液中不存在,但可以与NH3形成稳定的[Cu(NH3)2]+。
回答下列问题:
(1)为加快浸取速度,可以采取的措施是(任答两项)_______;在实际生产中采取常温下浸取而不采用加热的方法,其原因是___。
(2)浸取釜中有O2参与生成浸渣Fe(OH)CO3的离子方程式为_______。
(3)蒸发炉中加入(NH4)2SO3的主要作用是_________;沉降池1中加入稀H2SO4的作用是_______。
(4)在制取ZnSO4和CdSO4时使用硫酸的量要适当,如果硫酸过量,产生的后果是______。
(5)无论采用“高氧酸浸法”还是“高氧催化氧化氨浸法”,其前期处理,都要经过用浸取剂浸取这一步,不同的是“高氧酸浸法”需先高温焙烧,然后再用硫酸浸出。两种方法比较,“高氧酸浸法”存在的缺点是(任答两条)__________。
【答案】粉碎矿石,增大O2压强,增大氨水和碳酸铵的浓度 防止NH3的挥发,以便形成稳定的配合物,防止双氧水分解 4FeS+3O2+4CO32-+6H2O=4Fe(OH)CO3↓+4S↓+8OH- 将[Cu(NH3)4]2+还原为[Cu (NH3)2]+ 调节溶液的pH,使[Cu(NH3)2]+转化为Cu2O沉淀 产生H2S气体污染大气;降低锌钡白、CdS的产量 能耗高;设备耐酸性要求高;产生大量有害气体(SO2)污染大气
【解析】
由题干信息,分析流程图可知,高铁闪锌矿在浸取釜中与O2、碳酸铵、氨水、双氧水等组成的浸取剂反应生成S、Fe(OH)CO3、SiO2等不溶性物质、[Zn(NH3)4]2+、[Cu(NH3)4]2+和[Cd(NH3)4]2+,在蒸发炉中加入(NH4)2SO3将[Cu(NH3)4]2+还原为[Cu (NH3)2]+,进入沉降池1中加入稀H2SO4调节pH使[Cu(NH3)2]+转化为Cu2O沉淀,剩下的溶液在置换炉中加入适量锌粉得到Cd单质,滤液进入沉降池2加入碳化氨水得到Zn2(OH)2CO3,经稀硫酸得到ZnSO4溶液,ZnSO4与BaS溶液反应得到锌钡白,据此分析解答问题。
(1)由化学反应速率的影响因素可以知道,可采用粉碎矿石,增大O2压强,增大氨水和碳酸铵的浓度等方法加快浸取速率,由于浸取剂由碳酸铵、氨水、双氧水等组成,受热易分解,故在实际生产中采取常温浸取而不采用加热的方法,故答案为:粉碎矿石,增大O2压强,增大氨水和碳酸铵的浓度;防止NH3的挥发,以便形成稳定的配合物,防止双氧水分解;
(2)浸取釜中O2与碳酸铵和FeS反应生Fe(OH)CO3、S,反应的离子方程式为4FeS+3O2+4CO32-+6H2O=4Fe(OH)CO3↓+4S↓+8OH-,故答案为:4FeS+3O2+4CO32-+6H2O=4Fe(OH)CO3↓+4S↓+8OH-;
(3)Cu+在溶液中不存在,但可以与NH3形成稳定的[Cu(NH3)2]+,根据上述分析,(NH4)2SO3
中SO32-具有还原性,在蒸发炉中加入(NH4)2SO3可将[Cu(NH3)4]2+还原为[Cu (NH3)2]+,从而加入稀H2SO4调节pH使[Cu(NH3)2]+转化为Cu2O沉淀,故答案为:将[Cu(NH3)4]2+还原为[Cu (NH3)2]+;调节溶液的pH,使[Cu(NH3)2]+转化为Cu2O沉淀;
(4)在制取ZnSO4和CdSO4时使用硫酸过量会产生H2S气体污染大气并降低锌钡白、CdS的产量,故答案为:产生H2S气体污染大气,降低锌钡白、CdS的产量;
(5) “高氧酸浸法”需先高温焙烧,然后再用硫酸浸出,此法需要在高温条件,能耗高;对设备的耐酸性要求高;同时会产生大量有害气体(SO2)污染大气,故答案为:能耗高、设备耐酸性要求高、产生大量有害气体(SO2)污染大气。