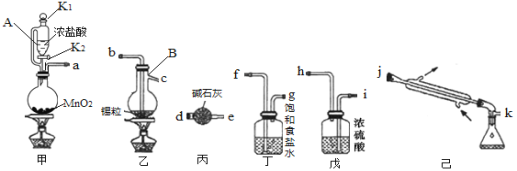
题目内容
【题目】工业合成氨缓解了有限耕地与不断增长的人口对粮食大量需求之间的矛盾。
(1)N2分子通常条件下非常稳定,其本质原因是_____,工业上选择500℃主要出于两方面考虑,一是反应速率快;二是_____。
(2)将1mol气态分子断裂成气态原子所吸收的能量叫键能。相关键能数据如下表:
共价键 | H-H | N≡N | N-H |
键能(kJ/mol) | 436 | 946 | 391 |
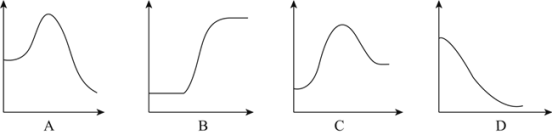
结合表中所给信息,下图中能正确表示合成氨反应过程中能量变化关系的是_____。
(3)一定条件下,氨与水的反应存在限度,氨水成弱碱性,用一个化学用语,表示氨与水反应及溶液显碱性的原因_____。
(4)硫酸铵是一种固态氮肥,俗称“肥田粉”。硫酸铵可由氨与硫酸反应生成,硫酸铵中含有的化学键类型有_____。
(5)氨氧化法可以用来生产硝酸,写出第一步和第三步的化学反应方程式_________________、_________________。
【答案】氮分子内存在氮氮叁键,氮氮叁键键能大 催化剂的活性最大 A NH3+H2O![]() NH3·H2O
NH3·H2O![]()
![]() +OH- 离子键、配位键、极性共价键 4NH3+5O2
+OH- 离子键、配位键、极性共价键 4NH3+5O2![]() 4NO+6H2O 3NO2+H2O=2HNO3+NO
4NO+6H2O 3NO2+H2O=2HNO3+NO
【解析】
(1)氮分子内存在氮氮叁键,氮氮叁键键能大,分子结构稳定;合成氨时温度要适宜,工业上选择500℃主要出于两方面考虑,一方面是反应速率快,另一方面是在这个温度时,催化剂的活性最大。答案为:氮分子内存在氮氮叁键,氮氮叁键键能大;催化剂的活性最大;
(2)由题给信息可知,反应N2(g)+3H2(g)![]() 2NH3(g) △H=946kJmol-1+436kJmol-1×3-391kJmol-1×6=-92kJmol-1<0,说明此反应为放热反应,反应物所具有的总能量大于生成物所具有的总能量,且化学键断裂需要吸收能量,据此可知符合合成氨反应过程中能量变化关系的图为A,故答案为:A;
2NH3(g) △H=946kJmol-1+436kJmol-1×3-391kJmol-1×6=-92kJmol-1<0,说明此反应为放热反应,反应物所具有的总能量大于生成物所具有的总能量,且化学键断裂需要吸收能量,据此可知符合合成氨反应过程中能量变化关系的图为A,故答案为:A;
(3)氨与水生成一水合氨,氨水呈弱碱性是因为一水合氨存在电离平衡,可以电离出氢氧根离子,水合过程和电离过程为:NH3+H2O![]() NH3·H2O
NH3·H2O![]()
![]() +OH-;答案为:NH3+H2O
+OH-;答案为:NH3+H2O![]() NH3·H2O
NH3·H2O![]()
![]() +OH-;
+OH-;
(4)硫酸铵是离子晶体,晶体内存在离子键、配位键、极性共价键;答案为:离子键、配位键、极性共价键;
(5)氨氧化法可以用来生产硝酸,其过程为氨催化氧化为NO,NO再氧化为NO2,最后NO2溶于水生成硝酸,第一步反应的化学反应方程式为4NH3+5O2![]() 4NO+6H2O,第三步反应的化学反应方程式为3NO2+H2O=2HNO3+NO。答案为:4NH3+5O2
4NO+6H2O,第三步反应的化学反应方程式为3NO2+H2O=2HNO3+NO。答案为:4NH3+5O2![]() 4NO+6H2O;3NO2+H2O=2HNO3+NO。
4NO+6H2O;3NO2+H2O=2HNO3+NO。

 阅读快车系列答案
阅读快车系列答案【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 H2SO4溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 H2SO4溶液
(1)若配制250 mL H2SO4溶液,则需量筒量取密度为1.84 g·cm-3,质量分数为98%的浓硫酸____mL。
Ⅱ.测定稀硫酸和稀氢氧化钠反应的中和热的实验装置如图所示:
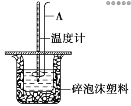
(2)仪器A的名称为___________。
(3)写出表示该反应中和热的热化学方程式:__________________。
(4)取50 mL NaOH溶液和30 mL H2SO4溶液进行实验,实验数据如下表。
实验 次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.6 | 26.6 | 26.6 | 29.1 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①温度差的平均值为____
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 H2SO4溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·(g·℃)-1。则测得的中和热ΔH=___________(取小数点后一位)。
③上述结果与57.3 kJ·mol-1有偏差,产生此偏差的原因可能是____(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.一次性把NaOH溶液倒入盛有H2SO4溶液的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)碎泡沫塑料的作用是___________。