题目内容
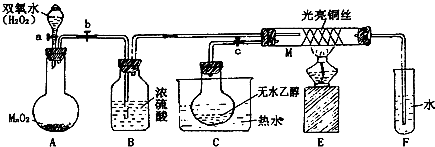
19.化学实验是化学学习与研究的基础.(1)某同学用下列装置(部分未画出)研究氨气与氧化铜的反应.

实验现象记录如下:黑色氧化铜粉末变为光亮红色;无水硫酸铜粉末变蓝色;集气瓶中收集到一种无色气体(进一步实验证明:该气体化学性质稳定).
①虚线框内所缺为干燥装置,采用的干燥剂为碱石灰.
②写出下列反应的化学方程式:
浓氨水与CaO固体反应:NH3•H2O+CaO=Ca(OH)2+NH3↑.
氨气与氧化铜反应:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O.
(2)下列实验过程中涉及到的反应物与生成物有:Cl2、KI、KCl、I2、HCl、H2O和一种未知物质X.
【实验】第一步:向盛有KI溶液、CCl4的试管中滴加氯水,CCl4层变成紫色.
第二步:继续向试管中滴加氯水,振荡,CCl4层逐渐变浅,最后呈无色.
①第一步反应中的氧化剂为Cl2.
②若第二步反应中,1mol I2被氧化失去10mol电子,则未知物X的化学式为HIO3.
分析 (1)①碱石灰可用来干燥碱性气体氨气;
②浓氨水与CaO固体反应生成氢氧化钙;氨气与氧化铜在加热条件下反应生成铜,氮气和水;
(2)①氯气有强氧化性,可将碘化钾中的碘离子氧化为碘单质;
②1mol I2被氧化失去10mol电子,则一个碘原子在反应中失去5个电子.
解答 解:(1)左边产生的气体是碱性气体氨气,应用碱石灰干燥,故答案为:碱石灰;
②浓氨水与CaO固体反应生成氢氧化钙和氨气,反应的化学方程式为:NH3•H2O+CaO=Ca(OH)2+NH3↑;氨气与氧化铜在加热条件下反应生成铜、氮气和水,反应的化学方程式为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O,
故答案为:NH3•H2O+CaO=Ca(OH)2+NH3↑;2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;
(2)①氯气有强氧化性,可将碘化钾中的碘离子氧化为碘单质,
故答案为:Cl2;
②1molI2被氧化失去10mol电子,则一个碘原子失去5个电子,反应后大于水的化合价为+5价,反应的化学方程式为:5Cl2+I2+6H2O═2HIO3+10HCl,
故答案为:HIO3.
点评 本题考查了氨气的制取及性质,题目难度中等,注意掌握氨气的制取方法及化学性质,明确氧化还原反应中得失电子与化合价变化的关系,试题培养了学生的分析能力及化学实验、化学计算能力.

练习册系列答案
相关题目
10.pH=3的盐酸用水稀释,体积变为原体积的2倍后,这时溶液的pH接近于(已知lg2=0.3、lg3=0.5、lg5=0.7)( )
| A. | 1.5 | B. | 3.3 | C. | 3.5 | D. | 2.7 |
14.在0.1mol/L的CH3COOH溶液中,要促进醋酸电离,且c(H+)增大,应采取的措施是( )
| A. | 加入0.1mol/L HCl | B. | 加入NaOH溶液 | ||
| C. | 升温 | D. | 加水 |
11.下列关于化学与生活的有关叙述不正确的是( )
| A. | 棉花、羊毛、木材和草类的纤维都是天然纤维,人造毛、人造丝是合成纤维 | |
| B. | 哥本哈根会议重点讨论了地球环境问题,其中破坏臭氧层的氟氯代烷是一类多卤代烃,主要含氟和氯的烷烃衍生物,有的还含有溴原子 | |
| C. | 煤的干馏产物有焦炭、煤焦油、焦炉气、粗氨水和粗苯等 | |
| D. | 肥皂和合成洗涤剂的去污原理相似,固态的合成洗涤剂就是洗衣粉,加入蛋白酶可以提高对血迹、奶迹等蛋白质污物的去污能力 |
14.下列实验基本操作(或实验注意事项)中,主要是出于实验安全考虑的是( )
| A. | 可燃性气体的验纯 | |
| B. | 实验剩余的药品不能放回原试剂瓶 | |
| C. | 滴管不能交叉使用 | |
| D. | 气体实验装置在实验前进行气密性检查 |