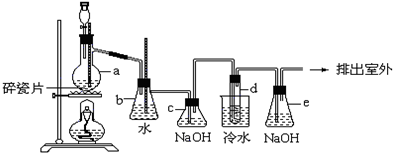
题目内容
9.有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某同学设计了如图装置(夹持装置仪器已省略),其实验操作为:按图安装好,先关闭活塞a、b、c,在铜丝的中间部分加热片刻.然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)通入气体,即可在M处观察到明显的实验现象.试回答以下问题: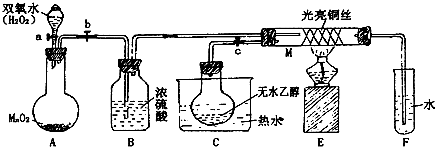
(1)A中发生反应的化学方程式:2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,B的作用:干燥O2;C中热水的作用:C中热水使D中乙醇变为蒸气进入M中参加反应.
(2)M处发生反应的化学方程式为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O.
(3)M管中可观察到的现象:受热部分的铜丝由于间歇性地鼓入空气而交替出现变黑,变红的现象,从中可认识到该实验过程中催化剂参加(填“参加”或“不参加”)化学反应,还可以认识到催化剂起催化作用需要一定的温度.
(4)验证乙醇氧化产物的试剂是新制氢氧化铜悬浊液,并写出对应的化学方程式2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O.
(5)若试管F中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有CH3COOH,要除去该物质,可先在混合液中加入c(填写字母).
a、氯化钠溶液 b、苯 c、碳酸氢钠溶液 d、四氯化碳.
分析 (1)A中是过氧化氢在二氧化锰催化作用下生成水和氧气;B是吸收氧气中的水蒸气;C是加热乙醇得到乙醇蒸气进入M;
(2)M处是乙醇的催化氧化反应生成乙醛;
(3)铜丝做催化剂,和氧气反应生成氧化铜,和乙醇反应又生成铜;催化剂参加反应过程,催化作用需要一定的温度;
(4)乙醇氧化为乙醛,依据醛基检验方法进行设计实验,可以利用新制的氢氧化铜加热检验;
(5)紫色石蕊试纸检验,试纸显红色,说明氧化产物含有乙酸可以加入碳酸氢钠溶液除去.
解答 解:(1)A中是过氧化氢在二氧化锰催化作用下生成水和氧气,反应的化学方程式为2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;B是吸收氧气中的水蒸气;C是加热乙醇得到乙醇蒸气进入M,
故答案为:2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;干燥O2;C中热水使D中乙醇变为蒸气进入M中参加反应;
(2)M处发生的反应是乙醇的催化氧化反应生成乙醛,反应的化学方程式为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O;
(3)铜丝做催化剂,和氧气反应生成氧化铜,和乙醇反应又生成铜,热部分的铜丝由于间歇性地鼓入空气而交替出现变黑,变红的现象;催化剂参加反应过程,催化作用需要一定的温度,
故答案为:受热部分的铜丝由于间歇性地鼓入空气而交替出现变黑,变红的现象;参加;温度;
(4)乙醇氧化为乙醛,依据醛基检验方法进行设计实验,可以利用新制的氢氧化铜加热生成砖红色沉淀判断反应的化学方程式为:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O,
故答案为:新制氢氧化铜悬浊液,CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O;
(5)若试管F中收集到的液体用紫色石蕊试纸检验,试纸显红色.说明产物中含有乙酸,加入试剂
a、氯化钠溶液不能除去,故a不符合;
b、苯不能除去乙酸,故b不符合;
c、碳酸氢钠溶液 和乙酸反应生成盐除去,故c符合;
d、四氯化碳不能除去乙酸,故d不符合;
故答案为:CH3COOH;c.
点评 本题考查了物质现在的实验验证方法和实验设计,主要是过氧化氢的分解反应,乙醇的催化氧化产物判断和检验,题目难度中等.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案| A. | 人体中的糖类、油脂和蛋白质都能为人的生命活动提供能量 | |
| B. | 淀粉和纤维素$\stackrel{水解}{→}$葡萄糖$\stackrel{氧化}{→}$CO2和H2O(释放能量维持生命活动) | |
| C. | 油脂$\stackrel{水解}{→}$甘油和高级脂肪酸$\stackrel{氧化}{→}$CO2和H2O(释放能量维持生命活动) | |
| D. | 蛋白质$\stackrel{水解}{→}$氨基酸$\stackrel{合成}{→}$人体所需的蛋白质(人体生长发育、新陈代谢) |
| A. | SO2 | B. | SiO2 | C. | NH4Cl | D. | Mg |
| A. | 3c-a-b | B. | a+b-3c | C. | a+3b-2c | D. | a+3b-6c |
| A. | 石油常压分馏后可得到汽油、煤油等轻质油,以及润滑油、石蜡等 | |
| B. | 在制备环氧乙烷时发生下列反应 CH2=CH2+Cl2+Ca(OH)2→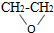 +CaCl2+H2O,此反应原子利用率达到了 100%° +CaCl2+H2O,此反应原子利用率达到了 100%° | |
| C. | 煤的干馏、煤的气化和液化能够实现煤的综合利用,且这三个变化都属于化学变化 | |
| D. | 含氮、磷的大量污水任意排放,会造成白色污染 |
| A. | pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+) | |
| B. | 0.1 mol/L的硫酸铵溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 0.1 mol/L的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 室温下,氢氧化钠与氯化铵的混合溶液的pH=7,则有c(Cl-)=c(NH4+)+c(Na+) |