题目内容
13.以下几句话中正确的有( )句①由两种元素组成的共价化合物的分子中的化学键都是极性键
②所有化学键都具有相同特征:方向性和饱和性
③分子晶体中相对分子质量越大则熔沸点一定越高
④只要是离子化合物,其熔点就比共价化合物的熔点高
⑤离子化合物形成的晶体一定是离子晶体,共价化合物形成的晶体一定是分子晶体
⑥分子晶体内可能没有共价键,而配位化合物中一定含有配位键
⑦含有极性键的分子不一定是极性分子,含有非极性键的化合物可能是离子化合物.
| A. | 1句 | B. | 2句 | C. | 3句 | D. | 4句 |
分析 ①共价化合物可能存在极性键、非极性键或都存在;
②离子键通过阴阳离子之间的相互作用形成,离子键没有方向性和饱和性,而共价键有方向性和饱和性;
③影响分子晶体熔、沸点的因素为氢键和相对分子质量;
④离子化合物的熔点不一定比共价化合物的熔点高;
⑤离子化合物形成的晶体一定是离子晶体,共价化合物形成的晶体一定是分子晶体;
⑥分子晶体中不一定含有共价键;
⑦含有极性键的分子不一定是极性分子,如四烷含极性键,但是非极性分子,含有非极性键的化合物可能是离子化合物,如过氧化钠中含有氧氧非极性键.
解答 解:①两种元素组成的共价化合物分子中也可能含有非极性键,如H2O2,故错误;
②离子键通过阴阳离子之间的相互作用形成,离子键没有方向性和饱和性,共价键是原子之间通过共用电子对形成,所以共价键有方向性和饱和性,故错误;
③影响分子晶体熔、沸点的因素为氢键和相对分子质量,所以相对分子质量大的熔、沸点不一定比相对分子质量小的高,例如水大于硫化氢,故错误;
④离子化合物的熔点不一定比共价化合物的熔点高,如二氧化硅的熔点大于NaCl的,故错误;
⑤离子化合物形成的晶体一定是离子晶体,共价化合物形成的晶体一定是分子晶体,故正确;
⑥分子晶体中不一定含有共价键,如稀有气体,而配位化合物中一定含有配位键,故正确;
⑦含有极性键的分子不一定是极性分子,如四烷含极性键,但是非极性分子,含有非极性键的化合物可能是离子化合物,如过氧化钠中含有氧氧非极性键,故正确;
综上所述3句正确,故选C.
点评 本题考查化学键,熟悉化学键形成的一般规律及常见物质中的化学键即可解答,并注意利用实例来解答,难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
18.下列溶液中微粒浓度关系一定正确的是( )
| A. | pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+) | |
| B. | 0.1 mol/L的硫酸铵溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 0.1 mol/L的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 室温下,氢氧化钠与氯化铵的混合溶液的pH=7,则有c(Cl-)=c(NH4+)+c(Na+) |
1.硅孔雀石的主要成分为CuCO3•Cu(OH)2和CuSiO3•2H2O,还含有SiO2、FeCO3、Fe2O3、Al2O3等杂质.以硅孔雀石为原料制取硫酸铜的工艺流程如下:

部分氢氧化物开始沉淀和完全沉淀的pH如下表
请回答下列问题:
(1)滤渣B的主要成分是Fe(OH)3、Al(OH)3(用化学式表示);判断本实验能否调节溶液pH使杂质完全除去而不损失Cu2+,并简述理由否,铝离子全部沉淀时铜离子有沉淀
(2)用离子方程式表示加入试剂A的作用2Fe2++H2O2+2H+═2Fe3++2H2O
(3)向滤液A中加入bd(填字母)除去杂质最合适.
a.氨水 b.氧化铜 c.氢氧化钠 d.氢氧化铜
(4)从滤液B中提取胆矾的操作包括蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、用滤纸吸干等.
(5)测定产品纯度和胆矾中结晶水数目
①沉淀法测定产品纯度
取一定质量的样品溶于蒸馏水,加入足量的BaCl2溶液和稀硝酸,过滤、洗涤、干燥、称重,实验结果发现测得的产品纯度偏高,可能的原因是acd(填字母)
a.产品失去部分结晶水 b.产品中混有CuCl2•2H2O c.产品中混有Al2(SO4)3•12H2O d.产品中混有Na2SO4
②差量法测得结晶水数目
取ag样品盛装在干燥的坩锅里,灼烧至结晶水全部失去,称得无水硫酸铜的质量b g,则胆矾(CuSO4•nH2O)中n值的表达式为$\frac{80(a-b)}{9b}$.

部分氢氧化物开始沉淀和完全沉淀的pH如下表
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 完全沉淀的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(1)滤渣B的主要成分是Fe(OH)3、Al(OH)3(用化学式表示);判断本实验能否调节溶液pH使杂质完全除去而不损失Cu2+,并简述理由否,铝离子全部沉淀时铜离子有沉淀
(2)用离子方程式表示加入试剂A的作用2Fe2++H2O2+2H+═2Fe3++2H2O
(3)向滤液A中加入bd(填字母)除去杂质最合适.
a.氨水 b.氧化铜 c.氢氧化钠 d.氢氧化铜
(4)从滤液B中提取胆矾的操作包括蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、用滤纸吸干等.
(5)测定产品纯度和胆矾中结晶水数目
①沉淀法测定产品纯度
取一定质量的样品溶于蒸馏水,加入足量的BaCl2溶液和稀硝酸,过滤、洗涤、干燥、称重,实验结果发现测得的产品纯度偏高,可能的原因是acd(填字母)
a.产品失去部分结晶水 b.产品中混有CuCl2•2H2O c.产品中混有Al2(SO4)3•12H2O d.产品中混有Na2SO4
②差量法测得结晶水数目
取ag样品盛装在干燥的坩锅里,灼烧至结晶水全部失去,称得无水硫酸铜的质量b g,则胆矾(CuSO4•nH2O)中n值的表达式为$\frac{80(a-b)}{9b}$.
8.咖啡鞣酸具有较广泛的抗菌作用,结构简式如图所示:关于咖啡鞣酸的下列叙述不正确的是( )
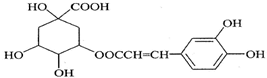
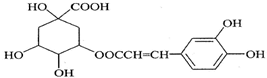
| A. | 分子式为C16H18O9 | |
| B. | 1 mol咖啡鞣酸水解时可消耗8molNaOH | |
| C. | 与苯环上碳直接相连的原子都在同一平面上 | |
| D. | 与浓溴水既能发生取代反应又能发生加成反应 |
2.2011年12月8日,滕州市自水厂消毒池进行升级改造,将原的用Cl2消毒改为用ClO2为自水消毒,变得更加安全、高效.实验室可通过以下反应制得ClO2:KClO3+H2C2O4+H2SO4→ClO2↑+K2SO4+CO2↑+H2O(未配平).下列说法正确的是( )
| A. | KClO3在反应中失去电子 | |
| B. | ClO2是氧化产物 | |
| C. | H2C2O4在反应中被氧化 | |
| D. | 1 mol KClO3参加反应有1 mol电子转移 |
3.NA代表阿伏加德常数,下列说法正确的是( )
| A. | 0.1mol/L Na2CO3溶液中含有0.2molNa+ | |
| B. | 在常温常压下,11.2L氮气所含的原子数目为NA | |
| C. | 2g氢气所含原子数目为NA | |
| D. | 在常温常压下,18 g水中含有的分子数为NA |

 元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分. .
.
 通过以下路线可合成(Ⅱ):
通过以下路线可合成(Ⅱ): $→_{△}^{浓H_{2}SO_{4}}$C3H4O2(Ⅲ)$\stackrel{C_{2}H_{5}OH/H+}{→}$C5H8O2$→_{一定条件}^{HBr}$(Ⅱ)
$→_{△}^{浓H_{2}SO_{4}}$C3H4O2(Ⅲ)$\stackrel{C_{2}H_{5}OH/H+}{→}$C5H8O2$→_{一定条件}^{HBr}$(Ⅱ) .
. ,反应类型是酯化反应(或取代反应).
,反应类型是酯化反应(或取代反应). .
.