题目内容
10.pH=3的盐酸用水稀释,体积变为原体积的2倍后,这时溶液的pH接近于(已知lg2=0.3、lg3=0.5、lg5=0.7)( )| A. | 1.5 | B. | 3.3 | C. | 3.5 | D. | 2.7 |
分析 PH=-lgC(H+),PH=3的盐酸,氢离子浓度为0.001mol/L,体积变为原体积的2倍后,根据公式C(H+)=$\frac{c({H}^{+})V}{2V}$计算;
解答 解:盐酸为一元强酸,根据PH=-lgC(H+),PH=3的盐酸,氢离子浓度为0.001mol/L,体积变为原体积的2倍后,C(H+)=$\frac{c({H}^{+})V}{2V}$=$\frac{0.001mol/L}{2}$=5×10-4mol/L,
PH=4-lg5=4-0.7=3.3,
故选B.
点评 本题考查了pH的有关计算,明确氢离子浓度、氢氧根离子浓度与溶液PH关系是解答的关键,题目难度不大.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
1.下列说法正确的是( )
| A. | 石油常压分馏后可得到汽油、煤油等轻质油,以及润滑油、石蜡等 | |
| B. | 在制备环氧乙烷时发生下列反应 CH2=CH2+Cl2+Ca(OH)2→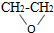 +CaCl2+H2O,此反应原子利用率达到了 100%° +CaCl2+H2O,此反应原子利用率达到了 100%° | |
| C. | 煤的干馏、煤的气化和液化能够实现煤的综合利用,且这三个变化都属于化学变化 | |
| D. | 含氮、磷的大量污水任意排放,会造成白色污染 |
18.下列溶液中微粒浓度关系一定正确的是( )
| A. | pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+) | |
| B. | 0.1 mol/L的硫酸铵溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 0.1 mol/L的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 室温下,氢氧化钠与氯化铵的混合溶液的pH=7,则有c(Cl-)=c(NH4+)+c(Na+) |
15.用物质的量都是0.1mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中c(CH3COO-)大于c(Na+),则( )
| A. | c(CH3COOH)+c(CH3COO-)=0.2mol/L | B. | c(H+)<c(OH-) | ||
| C. | c(CH3COOH)>c(CH3COO-) | D. | c(CH3COO-)+c(OH-)=0.2mol/L |
2.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 60g丙醇中存在的共价键总数为10 NA | |
| B. | 1L 0.1mol/L NaHCO3溶液中HCO3-和CO32-离子数之和为0.1 NA | |
| C. | 钠在空气中可生成多种氧化物.23g钠充分燃烧时转移电子数为1 NA | |
| D. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{34}^{136}$Xe+10${\;}_{0}^{1}$n,净产生的中子(${\;}_{0}^{1}$n)数为10 NA |


 通过以下路线可合成(Ⅱ):
通过以下路线可合成(Ⅱ): $→_{△}^{浓H_{2}SO_{4}}$C3H4O2(Ⅲ)$\stackrel{C_{2}H_{5}OH/H+}{→}$C5H8O2$→_{一定条件}^{HBr}$(Ⅱ)
$→_{△}^{浓H_{2}SO_{4}}$C3H4O2(Ⅲ)$\stackrel{C_{2}H_{5}OH/H+}{→}$C5H8O2$→_{一定条件}^{HBr}$(Ⅱ) .
. ,反应类型是酯化反应(或取代反应).
,反应类型是酯化反应(或取代反应). .
.