��Ŀ����
����Ŀ����֪AΪ�����еij���������CΪ���Ժ�ɫ���壬A��B��C��D֮��ת����ϵ

��1��д���������ʵĻ�ѧʽB_____________��C____________��
��2��C+�����B+D�����ӷ���ʽΪ__________________________________��D����Һ����Ϊӡˢ��·�塰��ʴҺ����д���÷�Ӧ�Ļ�ѧ����ʽ__________________________��
��3��ʵ���ұ���B����Һʱ����������A��ԭ����_________________�������ӷ���ʽ��ʾ��
��4����B��Һ�еμ�NaOH��Һ��������������___________________________����������������������ԭ��Ӧ�Ļ�ѧ����ʽ��____________________________��
���𰸡� FeCl2 Fe3O4 Fe3O4+8H+=4H2O+2Fe3++Fe2+ 2FeCl3+Cu= 2FeCl2+CuCl2 2Fe3++Fe=3Fe2+ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 ������ɫ������Ѹ�ٱ�ɻ���ɫ�����ձ�Ϊ���ɫ
����������AΪ�����еij���������CΪ���Ժ�ɫ���壬��CΪ Fe3O4��A��������Ӧ�õ�C����AΪFe��Fe��������Ӧ�õ�DΪFeCl3��Fe�����ᷴӦ�õ�B��Fe3O4�����ᷴӦҲ�õ�B����BΪFeCl2��
��1�����ʵĻ�ѧʽB ��FeCl2��C�� Fe3O4 ����2��C+������B+D�����ӷ���ʽΪFe3O4+8H+=4H2O+2Fe3++Fe2+ ��D����Һ����Ϊӡˢ��·������ʴҺ�����÷�Ӧ�Ļ�ѧ����ʽ��2FeCl3+Cu= 2FeCl2+CuCl2 ����3��ʵ���ұ���FeCl2����Һʱ����������Fe��ԭ���ǣ�2Fe3��+Fe�T3Fe2������ֹ����������������4����B��Һ�еμ�NaOH��Һ��������FeCl2��Һ�еμ�NaOH��Һ�������������ǣ�������ɫ������Ѹ�ٱ�ɻ���ɫ�����ձ�Ϊ���ɫ����������������������ԭ��Ӧ�Ļ�ѧ����ʽ�ǣ�4Fe(OH)2+O2+2H2O=4Fe(OH)3��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ����һ��ij��Һ�п��ܺ���Fe2����Mg2����Cu2����NH4����Al3���е�һ�ֻ��֡�������һ�ֵ���ɫ���岢������Һʱ���д̼�������ų��Ͱ�ɫ�������ɣ����뵭��ɫ��������ʵ����������꣩�����������Ͳ�����������ʵ����������꣩�Ĺ�ϵ������ͼ1��ʾ������д���пհף�
��1���ڸ���Һ�к��е�������_____________�����ʵ���Ũ��֮��Ϊ_______________��
��2�����ӵĵ���ɫ������________________����ѧʽ����

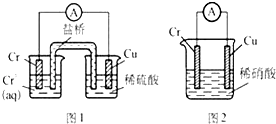
������������ʯ����Ҫ�ɷ�ΪFeS2������FeS���������������в���Fe��SԪ�أ��Ҹ����²�������ѧ�仯�������ҹ���������᳧��ȡ�������Ҫԭ�ϡ�ij��ѧ��ȤС��Ըû�����ʯ��������ʵ��̽������m1 g�û�����ʯ����Ʒ������ͼ2װ�ã��гֺͼ���װ���ԣ���ʯӢ���У���a�����ϵػ���ͨ��������������ջ�������Ʒ����Ӧ��ȫ���䷴Ӧ�Ļ�ѧ����ʽΪ��![]()
��ʵ��һ�����ⶨ��Ԫ�صĺ���
��Ӧ��������ƿ�е���Һ�������´�����

��3����Ӧ��������ƿ�е���Һ�������H2O2��Һ��Ŀ���ǣ��û�ѧ����ʽ��ʾ��________________________________________��
��4���û�����ʯ����Ԫ�ص���������Ϊ______________���г�����ʽ���ɣ���
��ʵ��������ⶨ��Ԫ�صĺ���

��5�����У���Ҫ�õ����������ձ�������������ͷ�ι��⣬����_________________��
��6��ijͬѧһ�����������εζ�ʵ�飬ʵ������¼���£�
ʵ����� | ��һ�� | �ڶ��� | ������ |
����KMnO4��Һ���/mL | 25.00 | 25.03 | 24.97 |
�����������ݣ������ϡ��Һ��Fe2+�����ʵ���Ũ��Ϊc(Fe2+) ��_______________��